Teplo z kosterního svalu může chránit nejen proti chladu ale i proti obezitě (27.2. 2023)
Tisková zpráva
Tvorba tepla (termogeneze) je nezbytná pro udržování stálé tělesné teploty, a je významnou složkou energetického výdeje. K dobře popsaným mechanismům, které se podílejí na tvorbě tepla, patří svalový třes nebo netřesová termogeneze v hnědé tukové tkáni. Termogeneze v hnědém tuku, která je závislá na přítomnosti mitochondriálního proteinu UCP1 (odpřahující protein 1), je středem zájmu pro její možné využití k léčbě obezity. Další mechanismy netřesové termogeneze a jejich význam jsou relativně málo probádány.
Vědci z Fyziologického ústavu Akademie věd ČR v Praze zkoumali tvorbu tepla u dvou různých kmenů laboratorních myší (C57BL/6J a A/J), které se liší náchylností k obezitě. U myší C57BL/6J lze obezitu vyvolat dietou s vysokým obsahem tuku, zatímco u myší A/J obezita za těchto podmínek nevzniká. Myši obou kmenů se dokázaly aklimatizovat na chlad s jenom malým snížením tělesné teploty, přičemž pro termogenezi zpočátku využívaly svalový třes. Delší pobyt v chladu vedl u myší náchylných k obezitě k aktivaci termogeneze v hnědé tukové tkáni. Myši odolné k obezitě však překvapivě nedokázaly hnědou tukovou tkáň aktivovat, ale zvýšila se u nich netřesová termogeneze v kosterních svalech. Při tvorbě tepla ve svalech se uplatňovalo zvýšené cyklování iontů vápníku v endoplazmatickém retikulu spojené s vyšší oxidační aktivitou mitochondrií.
Zapojení odlišných termogenních mechanismů by mohlo souviset s rozdílnou náchylností k obezitě. Rezistence myší A/J k obezitě je asi dána jejich schopností aktivovat netřesovou termogenezi ve svalech. Tyto výsledky publikované v časopise Molecular Metabolism také naznačují novou možnost pro léčbu obezity aktivací netřesové termogeneze ve svalech. To je asi nadějnější způsob léčby obezity než případná terapie založená na zvýšení termogeneze v hnědé tukové tkáni. Zejména proto, že u dospělého člověka je kapacita kosterního svalu pro spalování tukových energetických zásob mnohonásobně vyšší než v hnědé tukové tkáni. Jen relativně malé zvýšení termogeneze ve svalu by tak mohlo významně omezit ukládání tukové tkáně. Způsob, jak takového zvýšení dosáhnout, je výzvou pro další výzkum.
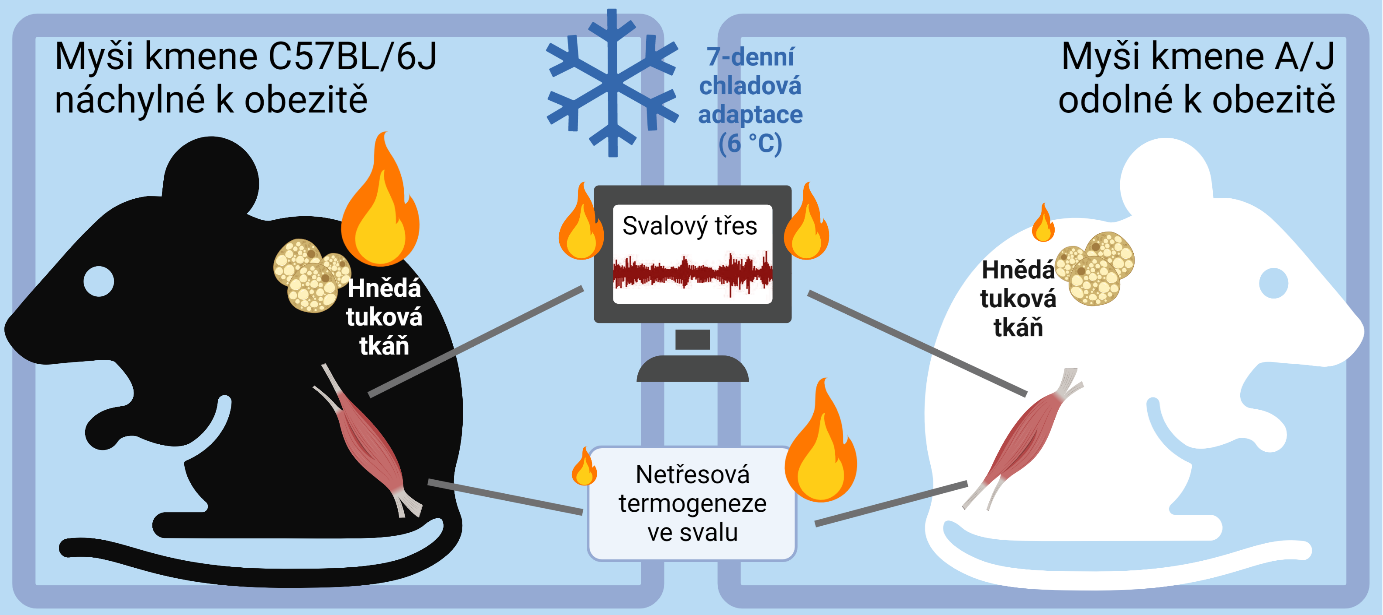
Janovska, P., P. Zouhar, K. Bardova, J. Otahal, M. Vrbacky, T. Mracek, K. Adamcova, L. Lenkova, J. Funda, T. Cajka, Z. Drahota, S. Stanic, A. C. Rustan, O. Horakova, J. Houstek, M. Rossmeisl and J. Kopecky (2023). „Impairment of adrenergically-regulated thermogenesis in brown fat of obesity-resistant mice is compensated by non-shivering thermogenesis in skeletal muscle.“ Mol Metab 69: 101683. IF = 8.568 DOI
Dát si prášek ráno nebo večer? Stabilizátor nálady lithium ovlivňuje mozek různě v závislosti na denní době (30.1. 2023)
Tisková zpráva
Lithium je účinný stabilizátor nálady, ale mechanismus jeho terapeutického účinku není dobře znám. Tým prof. Sumové z Fyziologického ústavu AV ČR zkoumal vliv lithia na cirkadiánní hodiny umístěné v komplexu komorové bariéry obsahující choroidní plexus, který je součástí glymfatického systému celkově ovlivňujícího mozkovou funkci prostřednictvím produkce mozkomíšního moku. Zjistili, že léčba lithiem u myší změnila úroveň exprese hodinového genu v choroidálním plexu. K podrobnějšímu studiu účinku lithia použili model transgenní myši s cirkadiánním reportérem (mPer2LUC) ke sledování chodu hodin choroidálního plexu v reálném čase. Když aplikovali lithium na choroidní plexus izolovaný z těchto myší a kultivovali jej v in vitro podmínkách, účinek na hodiny byl vysoce závislý na načasování aplikace. Lithium zpožďovalo hodiny po většinu dne, ale během krátkého okna způsobilo fázový posun. Pomocí specifických inhibitorů autoři prokázali, že účinek nebyl zprostředkován inhibicí enzymu GSK3, tedy kanonickým mechanismem lithia, ale spíše modulací aktivity PKC. Výsledky naznačují nový mechanismus terapeutického působení lithia, které uvádí do souladu funkci glymfatického systému souvisejícího s hodinami choroidálního plexu s cyklem spánku a bdění, což může zlepšit funkci mozku u psychiatrických pacientů. Data argumentují pro personalizované načasování léčby lithiem u pacientů s bipolární depresí.
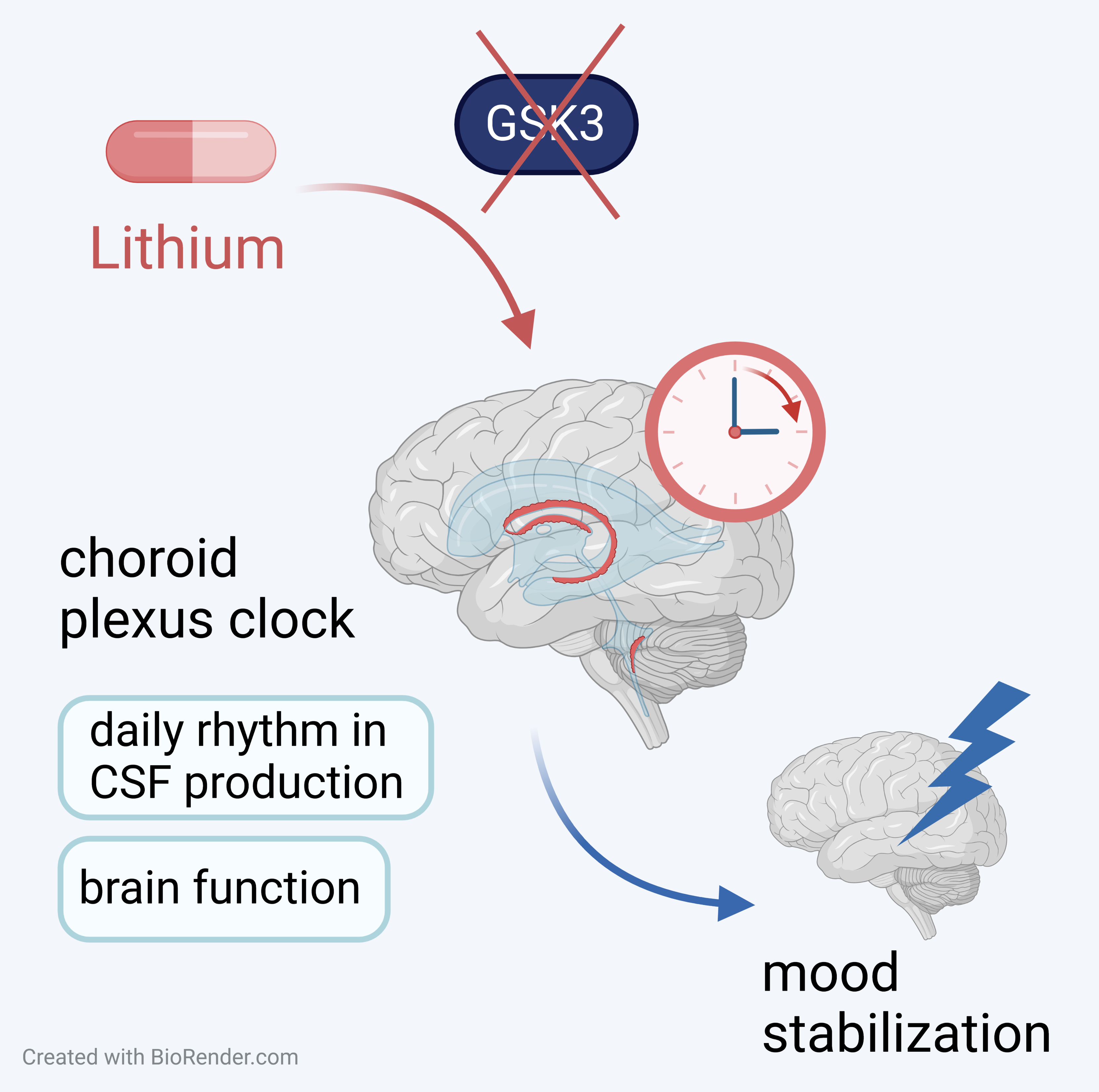
Liška K, Dočkal T, Houdek P, Sládek M, Lužná V, Semenovykh K, Drapšin M, Sumová A: Lithium affects the circadian clock in the choroid plexus – A new role for an old mechanism, Biomedicine & Pharmacotherapy, Vol. 159, March 2023, 114292, IF 7.419 DOI
Teplo nebo chlad? Nové poznatky o fungování iontových kanálů citlivých na změny teploty získané ve spolupráci s Univerzitou v Lundu (24.1. 2023)
Teplotně citlivé iontové kanály TRP jsou buněčnými molekulárními senzory zapojenými v přenosu smyslových signálů, vnímání bolesti (nocicepci) a udržování iontové homeostázy. Poruchy jejich funkce jsou příčinou mnoha závažných lidských onemocnění, jako jsou chronická bolest, zánět, rakovina a různá kardiovaskulární, neurologická, respirační, ledvinová a metabolická onemocnění. Očekávání vkládaná do vývoje nových léčiv zaměřených na tyto kanály zatím zůstávají nenaplněná vzhledem k jejich schopnosti být aktivován podněty různých modalit (polymodalitě), jejíž mechanismus stále není zcela objasněn. Mezinárodní tým vědců vedených Prof. Peterem M. Zygmundem (Lund University, Malmö, Sweden) ve spolupráci s vědci z Fyziologického ústavu Akademie věd ČR v Praze objasnil dva důležité mechanismy přispívající k polymodální regulaci TRP kanálů. První studie odhalila vazebné místo a molekulární podstatu vazby D9‑tetrahydrocannabiorcolu (přírodního rostlinného kanabinoidu bez psychotropních účinků), který napomáhá aktivaci TRPV2, čímž ovlivňuje přenos bolestivých podnětů. Druhá studie identifikovala dvě samostatné specifické oblasti, které propůjčují jinému receptoru TRPA1 citlivost na teplo (> 35 °C) a chlad (< 15 °C), a prokázala, že teplotní citlivost tohoto receptoru rozhodujícím způsobem závisí na oxidačním a redukčním prostředí. Dosažené výsledky významně přispívají k pochopení obecných molekulárních mechanismů chemické a teplotní aktivace kanálů rodiny TRP a naleznou využití při hledání možných přístupů k jejich regulaci pomocí léčiv.
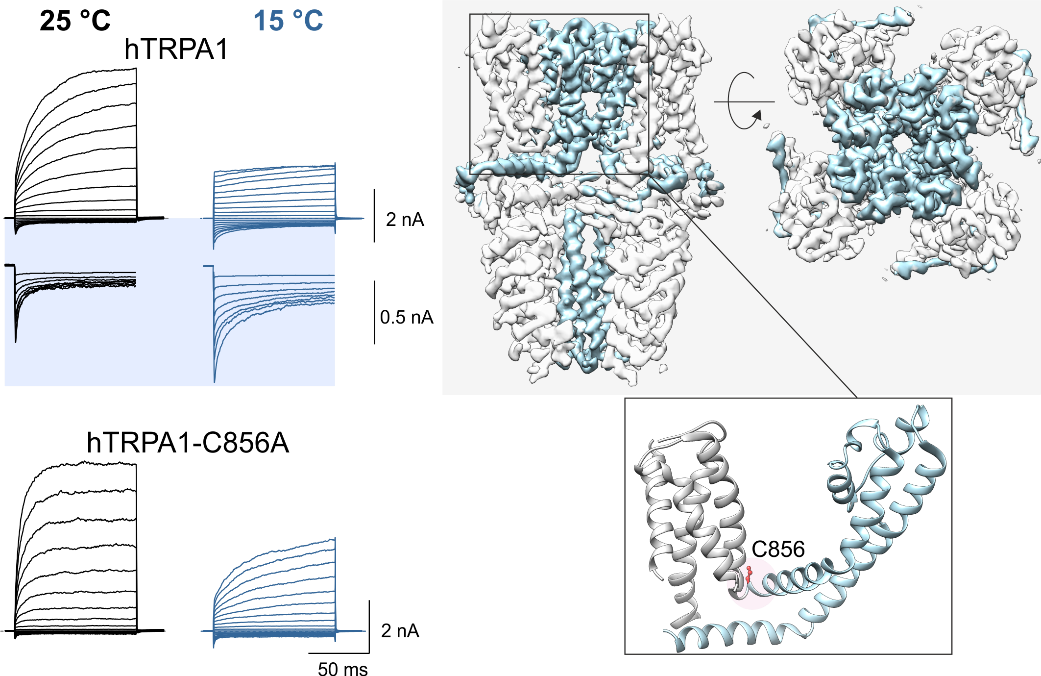
Vlevo: účinek chladu (15°C) na aktivaci lidského TRPA1 iontového kanálu přirozeného typu a mutantu, ve kterém je zaměněn hlavní aminokyselinový zbytek C856 zodpovědný za regulaci oxidačními a redukčními látkami. Kanály byly aktivovány sérií napěťových pulzů (od ‑160 mV do +200 mV).Vpravo: vizualizace struktury TRPA1 kanálu získaná kryoelektronovou mikroskopií (PDB: 6v9w) při pohledu ze strany a shora. Dynamické oblasti kanálu zodpovědné za aktivaci chladem jsou vyznačeny světle modrou barvou. Pozice cysteinu C856 je zobrazena na detailu struktury jedné podjednotky dole.
Moparthi, L. - Sinica, Viktor - Moparthi, V. K. - Kreir, M. - Vignane, T. - Filipovic, M. R. - Vlachová, Viktorie - Zygmunt, P. M.The human TRPA1 intrinsic cold and heat sensitivity involves separate channel structures beyond the N-ARD domain. Nature Communications. Roč. 13, č. 1 (2022), IF: 17.694 DOI
Zhang, L. - Simonsen, Ch. - Zímová, Lucie - Wang, K. - Moparthi, L. - Gaudet, R. - Ekoff, M. - Nilsson, G. - Hellmich, U. A. - Vlachová, Viktorie - Gourdon, P. - Zygmunt, P. M. Cannabinoid non-cannabidiol site modulation of TRPV2 structure and function. Nature Communications. Roč. 13, č. 1 (2022), IF: 17.694, rok: 2021 DOI
Odhalení nových regulačních mechanismů v lidském antiporteru Na+/H+ NHA2 (14.11. 2022)
Sodno/protonové antiportery jsou membránové proteiny, které se nacházejí ve všech živých buňkách od bakterií až po člověka a hrají důležitou úlohu v regulaci pH a koncentrací kationtů uvnitř buněk. Mezi tyto typy transportérů patří i antiporter NHA2, jehož aktivita ovlivňuje řadu fyziologických funkcí, např. sekreci inzulínu, zpětné vstřebávání sodíku v ledvinách nebo pohyblivost spermií. Antiporter NHA2 transportuje přes membránu kationty Na+ nebo Li+ výměnou za H+ a jeho aktivita je specificky inhibována phloretinem. Vlastnosti a funkce všech proteinů přímo vyplývají z jejich složení, tedy ze sekvence aminokyselin, které protein tvoří. V rodině antiporterů Na+/H+ má NHA2 jedinečnou strukturu. Skládá se z 537 aminokyselin uspořádaných do 14ti transmembránových domén a unikátního hydrofilního N-konce dlouhého 82 aminokyselin, jehož struktura a funkce nebyly dosud studovány. V časopise Protein Science jsme publikovali objev nových prvků ve struktuře NHA2 důležitých pro jeho funkci, včetně odhalení významné regulační úlohy N-konce proteinu.
Lidský protein NHA2 a jeho mutantní varianty jsme studovali pomocí jeho exprese v buňkách modelového eukaryotního organismu, kvasince Saccharomyces cerevisiae, a také pomocí bioinformatických simulací (ve spolupráci s laboratoří Prof. Nira Ben-Tala z Univerzity v Tel-Avivu). Identifikovali jsme několik nových aminokyselinových zbytků důležitých pro selektivitu antiporteru (rozpoznání a transport kationtů Na+ a Li+) a pro transport protonů. Dále jsme určili místo ve struktuře proteinu, kam se váže inhibitor phloretin. Odhalili jsme také, že unikátní hydrofilní N-koncová část proteinu má důležitou (autoinhibiční) úlohu v regulaci transportní aktivity NHA2, protože zkrácení N-konce o prvních 50-70 aminokyselin vedlo až k dvojnásobnému zvýšení transportní aktivity proteinu. Dosažené výsledky také ukazují, že expresní systém NHA2 v buňkách kvasinek je možné v budoucnu využít např. pro rychlé zjištění, jak mutace vyskytující se v NHA2 v lidském genomu ovlivňují aktivitu antiporteru a/nebo pro testování nových látek ovlivňujících funkci NHA2 podobně jako phloretin.
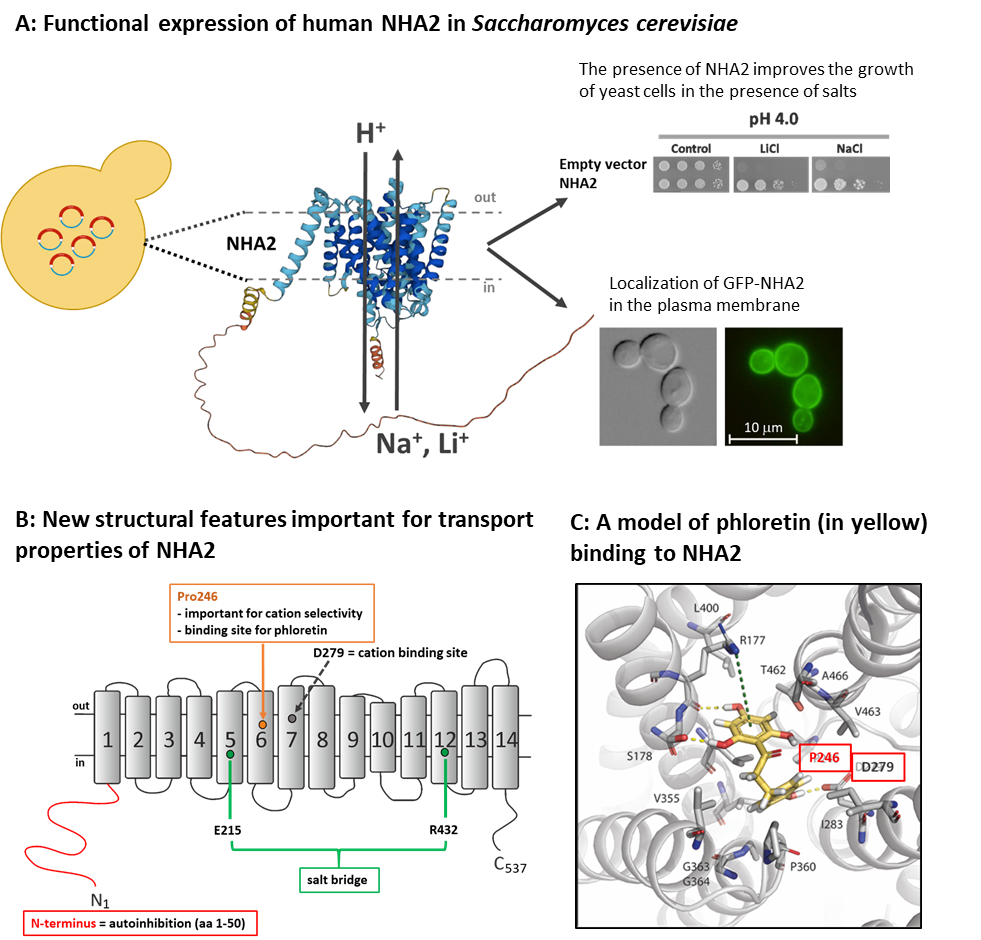
Velazquez D., Prusa V., Masrati G., Yariv E., Sychrova H., Ben-Tal N. and Zimmermannova O. (2022): Allosteric links between the hydrophilic N-terminus and transmembrane core of human Na+/H+ antiporter NHA2. Protein Sci: e4460. IF = 6.993 DOI
Thiazolidindiony (TZD) jsou látky používané při léčbě diabetu, které zvyšují citlivost k inzulínu. První generace TZD však vykazuje řadu nežádoucích účinků, včetně např. zvýšené tvorby velkých tukových buněk (adipocytů) v kostní dřeni spojené s vyšším rizikem zlomenin a úbytku kostní hmoty. Předpokládá se, že tyto vedlejší účinky jsou do jisté míry způsobeny silnou vazbou TZD na jaderný receptor PPARγ. V nové studii publikované v časopise Molecular Metabolism jsme zkoumali, jak metabolismus v kostech ovlivní podávání látky MSDC-0602K, nového analoga TZD s nižší afinitou k receptorům PPARγ.
Zjistili jsme, že podávání MSDC-0602K obézním myším po dobu 8 týdnů vedlo ve srovnání s původními TZD k výrazně lepší kostní struktuře a vyšší pevnosti kostí spolu se zvýšeným podílem menších adipocytů v kostní dřeni. Zkoumali jsme také působení látky MSDC-0602K na molekulární úrovni pomocí pokusů s primárními tkáňovými kulturami. Mezenchymální kmenové buňky kostní dřeně z myší ošetřených MSDC-0602K diferencovaly ve zvýšené míře do podoby osteoblastů (kostních buněk), nepodléhaly tolik stárnutí a vykazovaly zvýšený buněčný metabolismus glutaminu, který je důležitý pro tvorbu kostí (osteogenezi).
Ze studie vyplývá, že nový analog TZD by mohl ve srovnání s původními TZD zvyšovat citlivost k inzulínu s nižšími nežádoucími účinky na kvalitu kostí a metabolismus mezenchymálních kmenových buněk. Látka MSDC-0602K by tak mohla nahradit starší léčiva při léčbě metabolických a kostních onemocnění.
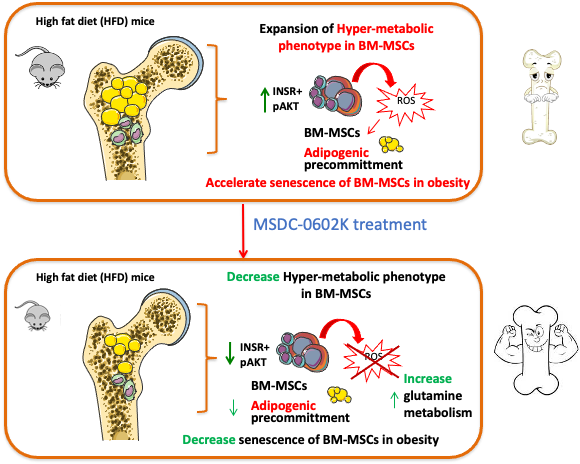
Benova, A., M. Ferencakova, K. Bardova, J. Funda, J. Prochazka, F. Spoutil, T. Cajka, M. Dzubanova, T. Balcaen, G. Kerckhofs, W. Willekens, G. H. van Lenthe, G. Alquicer, A. Pecinova, T. Mracek, O. Horakova, M. Rossmeisl, J. Kopecky and M. Tencerova (2022). "Novel thiazolidinedione analog reduces a negative impact on bone and mesenchymal stem cell properties in obese mice compared to classical thiazolidinediones." Mol Metab 65: 101598. IF = 8.568 DOI
Načíst další





