Projekty
Mechanismy účinku cytostaticky účinných nukleosidových / nukleotidových analogů a mechanismy vzniku rezistence | |

|
Dlouhodobým cílem projektu je u vybraných cytotoxických látek objasňovat molekulární podstatu jejich antiproliferačních účinků. Základem je popis prostupu látky do buňky, její metabolismus a identifikace účinných metabolitů. Studujeme apoptotické účinky látek a jejich vliv na distribuci buněčného cyklu. Dále sledujeme například vliv látek na proteinkinasovou nebo kaspasovou signalizaci, roli mitochondrií a membránových receptorů a interakce s telomerami / telomerasou. V současné době je v hledáčku projektu především profesorem Holým vyvinutý acyklický nukleosidfosfonát PMEG, jehož dvojité proléčivo GS-9219 je ve fázi klinického hodnocení jako chemoterapeutikum lymfomu. Znalost metabolismu a mechanismu účinku látek nám pak umožňuje identifikovat potenciální cílová místa vzniku rezistence a navrhnout možná řešení. U rezistentních buněčných kmenů studujeme expresi a funkci membránových přenašečů především ze skupin MDR (P-glykoprotein) a MRP, dále sledujeme fosforylační aktivitu klíčových kinas a citlivost rezistentních kmenů k ostatním běžně používaným cytostatikům (potenciál k navození mnohočetné lékové rezistence). |
Hypometylační účinky látek (epigenetika) | |

|
Epigenetika je vědní obor zabývající se změnou chování genů v důsledku chemických změn na povrchu DNA bez změny vlastního genetického kódu (sekvence nukleotidů). Mezi takové změny patří i metylace DNA, kde expresi genů ovlivňuje navázání metylové skupiny na řídící úsek genu. Hypermetylace CpG dinukleotidů ("CpG ostrůvků") tumor-supresorových genů je spojená s jejich inaktivací a může iniciovat vznik nádorového bujení. Jedná se o změny reverzibilní a s využitím látek s hypometylačními účinky je možné hypermetylovaný gen opětovně aktivovat. Tento typ léčby by mohl být u některých specifických (zvláště hematologických) malignit efektivnější a méně toxickou alternativou ke konvenční chemoterapii. V rámci projektu se zabýváme hledáním spolehlivých a účinných metod pro detekci metylované DNA, vyhledáváním nových látek s hypometylačními vlastnostmi a studiem jejich mechanismu účinku. |
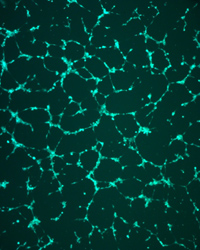
Antiangiogenní účinky látek | |
|
Angiogeneze je proces novotvorby krevních cév z existující vaskulatury. Je to komplexní a mnohastupňový proces, na němž se podílí množství mediátorů angiogeneze (složky extracelulární matrix, růstové faktory, integriny, cytokiny a enzymy) s inhibiční nebo naopak stimulační funkci. Dysregulace v procesu angiogeneze zapříčiňují celou řadu patologických stavů jako je např. revmatoidní artritida či diabetická retinopatie. V neposlední řadě je zvýšená angiogeneze nezbytná pro růst solidních tumorů a jejich schopnost metastazovat. Na našem pracovišti se dlouhodobě zabýváme identifikací inhibitorů thymidinfosforylasy (TP), enzymu katalyzujícího fosforolysu thymidinu na thymin a 2-deoxy-D-ribosa-1-fosfát. Angiogenní a antiapoptotické účinky TP (totožné s endoteliálním faktorem PD-ECGF) jsou velmi dobře popsány. Zejména některé nové 5-substituované 6-chlorouracilové deriváty vykázaly na lidské TP izolované z placenty nebo získané rekombinantní technologií významný účinek charakterizovaný inhibičními konstantami v submikromolárních koncentracích (Nencka et al., 2007). Kromě inhibitorů TP se zabýváme i vlivem vybraných látek na některé další angiogenní působky (např. VEGF). V současné době zavádíme nové in vitro modely pro hodnocení antiangiogenních účinků látek na buněčných systémech - konkrétně se jedná o ovlivnění chemotaktického chování vaskulárních endoteliálních buněk (migrace přes mikroporézní membránu) a jejich schopnosti diferencovat za vzniku kapilárních struktur (tzv. tubulogeneze). |
Mitochondriální toxicita nukleosidových/nukleotidových analogů | |

|
V rámci tohoto projektu se zabýváme mechanismy mitochondriální toxicity nukleosidových / nukleotidových analogů s protivirovými nebo cytostatickými účinky. U řady strukturně příbuzných látek byla prokázána souvislost s mitochondriální dysfunkcí, kterou nelze vysvětlit výlučně inhibicí DNA polymerázy γ. Faktory, které spouštějí nebo provázejí mitochondriální dysfunkci zahrnují nejen poškození mitochondriální DNA (mtDNA), ale také ztrátu mitochondriálního membránového potenciálu (ΔΨm), translokaci cytochromu c, zvýšenou produkci reaktivních kyslíkových radikálů (ROS) atd. Našim cílem je popsat jednotlivé charakteristiky cytotoxicity nukleosidových/nukleotidových analogů s důrazem na oxidační stres způsobený nadprodukcí ROS. Ten přispívá např. k urychlenému zkracování telomer a buněčnému stárnutí (senescenci). Pro prvotní evaluaci mitochondriální toxicity nově syntetizovaných látek plánujeme využití fluorescenčních analytických metod zahrnujících měření produkce ROS a mitochondriálního membránového potenciálu (ΔΨm) v buněčné kultuře a měření spotřeby kyslíku izolovanými mitochondriemi. V další části projektu se zaměříme na popis vztahů mezi strukturou a mitochondriální toxicitou látek. Budeme hodnotit rovněž přímé antioxidační/prooxidační účinky látek, což přispěje k rozlišení přímých a nepřímých účinků látek na výsledné hladině ROS v buňce. Tyto strukturně-aktivitní studie významně přispívají k racionálnímu designu nových léčiv se sníženými nežádoucími účinky. |