
|
| Hlavní stránka | Webmail |
|
Co
děláme - informace pro veřejnost
Odd. biologie cytoskeletu Vedoucí doc. Pavel Dráber Cytoplazmu buněk prostupují vlákna nazývaná souhrně cytoskelet. Jde o proměnlivou síť, která obklopuje ostatní vnitrobuněčné struktury, určuje tvar a pružnost buňky, umístění organel, odpovídá za všechny druhy buněčného i vnitrobuněčného pohybu jako je např. putování chromozomů během buněčného dělení, pohyb organel uvnitř buňky, pohyb bičíků a řasinek nebo svalový stah. Cytoskeletální proteiny se účastní i přenosu signálů a buněčného metabolizmu. Cytoskelet tak funguje v buňce jako jeden z nejdůležitějších organizačních systémů. Nejdynamičtější složkou cytoskeletu jsou vlákna nazývaná mikrotubuly, tvořená hlavně proteinem zvaným tubulin. Mnoho poznatků získaných při studiu cytoskeletetu je uplatňováno v medicínské praxi. Při léčbě nádorových onemocnění se používají mikrotubulární inhibitory (např. taxol, vinblastin, kolchicin), které záblokují buněčné dělení. U řady neurodegenerativních onemocnění (např. Alzheimerova choroba) byly prokázány defekty v cytoskeletálních proteinech a detekce těchto změn může najít uplatnění v časné diagnostice. těchto nemocí. Naše laboratoř se dlouhodobě zabývá objasňováním struktury a funkce proteinů tvořících mikrotubuly a jejich změn za normálních a patologických podmínek. Zaměřujeme se na poznání mechanismů organizace mikrotubulů a na roli klíčového proteinu v tomto procesu - γ-tubulinu. Využíváme přitom panel unikátních monoklonálních protilátek, metody molekulární genetiky a nejmodernější mikroskopické techniky. Odd. biologie buněčného jádraVedoucí prof. Pavel HozákBuněčné jádro je nositelem genetické informace, která je zapsána ve vláknech molekul DNA. Tato vlákna jsou v jádře složitě uspořádána, za pomoci mnoha bílkovin je genetická informace čtena, její chyby opravovány a po jejím zdvojení je buňka připravena dělit se. Protože se jedná o zásadní děje pro život, je důležité pochopit, jak je vnitřek jádra molekulárně uspořádán a jak jsou regulovány pochody, které v něm probíhají. V neposlední řadě také proto, že narušení „pořádku“ uvnitř jádra vede ke vzniku závažných onemocnění. V naší laboratoři proto využíváme metody molekulární biologie a světelné i elektronové mikroskopie, abychom popsali zákonitosti procesů probíhajících uvnitř jádra. V současnosti se zabýváme hlavně třemi problémy. Prvním je, jak připravit vzorky pro pozorování v elektronové mikroskopii, která vzorky vystavuje vakuu a bombardování elektrony. Vyvíjíme takové postupy přípravy vzorků (založené na vysokotlakém zamražování na teplotu tekutého dusíku), které zajistí, aby vzorky i při takto obtížných podmínkách pozorování co nejvíce odpovídaly přirozenému stavu. Druhou oblastí je studium speciální jaderné bílkoviny – myosinu IC. Myosiny jsou odpovědné za svalový a buněčný pohyb; prokázali jsme ale, že jsou přítomny i v jádře a že se spolupodílí na procesu čtení genetické informace. Snažíme se zjistit, jestli se tak děje pomocí „molekulárního motoru“, který posunuje DNA vůči „čtecí hlavě“, anebo nějakým jiným mechanismem. Třetí oblastí výzkumu je popis molekulární struktury bílkovinné sítě uvnitř jádra, ke které se DNA napojuje a která slouží k jejímu správnému uložení. Obdobnou síť známe z cytoplasmy, která buněčné jádro obklopuje – v jádře je ale popsána dosud nedostatečně, ačkoliv její poruchy vedou k vážným onemocněním. Buněčné jádro je fascinující organelou, kde se složité principy genetiky pojí s komplikovaným prostorovým uspořádáním DNA a všech bílkovin, které s ní spolupracují během života buňky. Náš výzkum přispívá k pochopení regulace fungování jednotlivých genů a vzniku různých onemocnění, např. zvýšené citlivosti na podněty, způsobující rakovinu, nebo různých typů onemocnění svalových a pojivových tkání. V budoucnu pak mohou tyto poznatky přispět k vývoji nových způsobů léčby a prevence těchto onemocnění. Odd. biologie RNAVedoucí dr. David Staněk Laboratoř se zabývá objasňováním mechanismů sestřihu velmi dlouhých molekul RNA (tzv. pre-mRNA) vzniklých přepisem genů. Aby mohla být tato sekvence dále přeložena do sekvence aminokyselin v bílkovinách, musí být pre-mRNA zkráceny ("sestříhány"). Vystřihnuty jsou introny - nekódující, často rozsáhlé oblasti, o jejichž funkci toho dodnes není mnoho známo. Vystřihnuty však mohou být i některé kódující sekvence, takže z jednoho genu může vzniknout několik různých mRNA (alternativní sesřih) a tudíž i několik různých bílkovin, čímž se výrazně rozšiřují kódující možnosti lidského genomu. Ačkoliv se v polední době ukazuje, že alternativní sestřih je pro vývoj člověka zcela zásadní, o jeho pravidlech toho stále příliš nevíme. Sestřih pre-mRNA probíhá v buněčném jádře za účasti velkého komplexu složeného ze stovek bílkovin. Po každém sestřihu pre-mRNA se tento sestřihový komplex rozpadá a buňka ho musí znovu recyklovat. Jednou z otázek, které laboratoř v současné době řeší, je zjistit, jak a kde jsou v buněčném jádře tyto obrovské sestřihové komplexy skládány a jak je jejich obnovení po sestřihu regulováno. Mutace v některých základních stavebních bílkovinách sestřihového komplexu způsobují dědičné onemocnění oka (retinitis pigmentosa) a jedním z našich cílů je odhalit, jak tyto mutace ovlivňují formování sestřihového komplexu a přispět tak k objasnění vzniku této choroby. Odd. buněčné diferenciaceVedoucí dr. Petr BartůněkNaše laboratoř využívá metod chemické genetiky k výzkumu obecných procesů probíhajících v buňce. Chemická genetika je poměrně nový obor na pomezí biologie a chemie. Cílem metod chemické genetiky je snaha o identifikaci malých organických molekul, které mohou být následně velmi široce použity např. jako nástroje pro další výzkum v oblasti biomedicíny nebo jako základ pro vývoj nových léčiv. Technologicky se jedná o přístupy založené na testování s vysokou propustností (high-throughput screening – HTS) pomocí integrovaného robotického zařízení, které umožňuje testovat desetitisíce až statisíce sloučenin v krátkém časovém úseku. Výsledky naší práce by měly vést k porozumění molekulárních mechanizmů signálních drah ovlivňujících rozhodovací procesy při přeměně hematopoetických, mezenchymálních a nervových kmenových buněk. Zvláštní pozornost věnujeme výzkumu úlohy jaderných receptorů, které jsou důležitými faktory v procesech buněčné proliferace a diferenciace. Konečným cílem naší práce by měly být nové a komplexnější znalosti o příčinách vzniku chorob na molekulární úrovni a o možnostech ovlivnění patofyziologických drah v buňce. Tyto znalosti by měly přispět k zlepšení prevence a léčby závažných lidských onemocnění, jako např neurodegenerativních a nádorových onemocnění nebo diabetu. Odd. buněčné signalizace a apoptózaVedoucí dr. Ladislav AnděraLaboratoř se zabývá objasňováním mechanismů, které spouštějí a regulují procesy tzv. řízené buněčné smrti neboli apoptosy. Apoptosa může být vyvolána vnějšími či vnitřními podněty a její předčasná či nedostatečná iniciace bývá jednou z příčin závažných chorob včetně nádorových, neurodegenerativních či autoimunitních onemocnění. Apoptosa může být vyvolána signalizací přes tzv.„receptory smrti“. Mezi ně patří námi studované membránové receptory DR4 a DR5, které vyvolávají apoptosu poté, co se na ně naváže protein (cytokin) zvaný TRAIL. Důležité je, že TRAIL vyvolává apoptosu mnohých nádorových, ale nikoli normálních lidských buněk. Jeví se proto jako nadějný protinádorový terapeutický prostředek a jeho použitelnost je ověřována v klinických testech. V současné době také analyzujeme roli dalšího „receptoru smrti“ – „Death Receptoru 6“ (DR6) v regulaci imunitních odpovědí. Zabýváme se také vnitrobuněčným nádorovým supresorovým proteinem p53 a objasňujeme roli multifunkčního adapterového proteinu Daxx. Daxx se vyskytuje jak v buněčném jádře, tak i v cytoplasmě a může apoptosu normálních i nádorových buněk buď aktivovat či potlačovat. V současnosti objasňujeme funkci několika nových proteinů (např. Brg1), které se váží na protein Daxx. Naše práce by měla kromě základních biologických poznatků také směřovat k vývoji potenciálních nových léčebných postupů pro některá nádorová onemocnění. Odd. buněčné a virové genetikyVedoucí dr. Jiří HejnarV této laboratoři se zabýváme tzv. retroviry (některé způsobují nádory nebo jiná závažná onemocnění, jako např. AIDS) a jejich vztahy s hostitelskými buňkami. Pracujeme převážně s modelovými viry, které napadají buňky ptáků, vyvolávají nádory nebo leukemie u kuřat, ale nepředstavují žádné riziko pro člověka. Pro tento typ virů máme vynikající zázemí v chovech experimentální drůbeže, které byly vyšlechtěny speciálně na citlivost k těmto laboratorním kmenům virů. V menší míře pracujeme s viry vyvolávajícími leukemie u myší a s virem HIV-1. Zajímají nás bílkovinné molekuly na povrchu hostitelských buněk, které retroviry využívají pro vstup do buňky a jejichž přítomnost nebo nepřítomnost rozhoduje, zda je daná buňka vůči konkrétnímu typu viru citlivá nebo rezistentní. Protože upravené retroviry se používají také pro experimentální vnášení genů do buněk nebo celých organismů, snažíme se o zdokonalování těchto retrovirových „vektorů“ a zajištění jejich dlouhodobého fungování v takto geneticky upravených buňkách. Naše ptačí retroviry lze rovněž využít pro vytváření slepičích linií produkujících prakticky užitečné bílkoviny ve velkém množství ve vaječném bílku. Snažíme se také objasnit mechanismy, pomocí kterých buňka reguluje přepis genetické informace po infekci retroviry. Např. virus HIV-1 setrvává dlouhodobě v latentním stavu a poznání mechanismů této latence je důležité pro prevenci a léčbu onemocnění AIDS. Některé geny retrovirů byly v průběhu evoluce buňkou „ochočeny“ a využity pro specializované buněčné funkce. Zabýváme se dvěma původně retrovirovými geny, které napomáhají vývoji placenty u člověka a ostatních primátů. Ty ale musí být „vypnuty“ v ostatních tkáních, kde by jinak mohly způsobovat patologické změny. V poslední době se zabýváme také latentními („spícími“) retroviry přítomnými ve všech prasečích buňkách, které by mohly být aktivovány a přeneseny na člověka při transplantaci prasečích orgánů. Odd. buněčné a vývojové biologieVedoucí dr. Vladimír KořínekOsud každé buňky v těle ovlivňuje relativně malé množství tzv. signalizačních drah, které určují většinu důležitých fyziologických dějů a zajišťují tak správné fungování těla. Jedna taková důležitá signální dráha je založena na skupině proteinů zvaných Wnt. Proteiny Wnt působí jako „morfogeny“, protože řídí dělení, diferenciaci a přežívání buněk v různých typech embryonálních i dospělých tkáních. Chybné spouštění této signalizace způsobuje rakovinu střeva, kůže, jater, mléčné žlázy a dalších orgánů. Vazba roteinů Wnt na buněčné receptory zvané Frizzled spouští vnitrobuněčné děje, kterých se účastní klíčová bílkovina β-katenin. Vazba proteinů Wnt na membránové receptory vyvolává vzájemně provázané biochemické reakce, jejichž výsledkem je výrazný nárůst množství β-kateninu v buňce a jeho vstup do buněčného jádra. V jádře se -katenin váže na tzv. transkripční faktory rodiny TCF/LEF, což vede k přepisu skupiny tzv. cílových genů. Řada těchto genů je již známá, ale většina jich zřejmě teprve čeká na objevení a podrobnou charakterizaci.Konečným výsledkem signalizace Wnt je pak syntéza celé řady proteinů a s tím související celková změna v chování buňky (zastavení vyzrávání a zahájení dělení). Hlavním tématem naší laboratoře je vyhledávání genů, které jsou „zapínány“ signalizací Wnt v savčích buňkách, a to zejména ve sliznici střeva, v játrech, a také v nádorech střevního nebo jaterního původu. Výsledky tohoto výzkumu by mohly přispět k vysvětlení molekulárních mechanismů rozhodujících o fungování zdravých buněk a jejich přeměně v buňky nádorové. Takové základní poznatky jsou předpokladem k racionálnímu hledání postupů bránících vzniku a růstu nádorů. Odd. epigenetických regulacíVedoucí dr. Petr SvobodaLaboř se zabývá třemi tématy: 1) Studium mechanismů, které v savčích buňkách dokáže vyvolat dvoušroubovice RNA (dsRNA). Jedním z těchto mechanismů je tzv. RNA interference, která způsobí likvidaci všech RNA molekul, které mají identickou sekvenci k dsRNA. 2)
Regulace tzv. mobilních elementů v genomu. Jenom
malá
část savčího genomu
kóduje geny. Zbytek je tvořen tzv. repetitivní
DNA.
Část repetitivní DNA tvoří elementy,
které
se dokáží zkopírovat a integrovat na
nové
místo. To může být nebezpečné, protože
integrace takového elementu do genu jej může
poškodit. L1
element, který studujeme, tvoří 17%
lidského
genomu. To je důsledkem více než 500 000 inzercí
do
genomu. To je v porovnání s počtem
lidských
genů, kterých je něco kolem 30 000, velmi
vysoké
číslo. Ovšem naprostá
většina L1 elementů je
neaktivnách. Nás zajímá,
jakým
způsobem buňky tyto elementy rozpoznávají a
umlčují
a jestli nějakou roli hraje RNA z L1 elementů. 3) Reprogramování genomu během oplození. Vajíčko je prakticky terminálně diferencovaná buňka, která se nedělí. Ovšem po oplození se promění v kmenovou buňku, která nastartuje program pro vývoj celého organismu. Zajímavé je, že během této změny jsou geny víceméně neaktivní (netvoří RNA) a celý proces je řízen proteiny a RNA, které jsou ve vajíčku již na začátku ovulace. Nás zajímá, jakou roli v tomto procesu hraje stabilita RNA a jaké mechanismy odstraňují RNA, která není potřeba, nebo by překážela dalšímu vývoji. Odd. genomiky a bioinformatikyVedoucí dr. Čestmír VlčekŽivotní pouť každého organizmu na Zemi je do značné míry předurčena v molekulách DNA, které jsou uloženy v jaderných strukturách buňky zvaných chromozómy. Celkový soubor dědičné informace zapsané v jednotlivých chromozómech se nazývá genom. Studium genomů dnes představuje samostatný rychle se rozvíjející obor vědy o životě, který je nazýván genomika. Nová generace technologií nám dnes umožňuje číst genomy nejrůznějších organizmů za nesrovnatelně kratší dobu než tomu bylo ještě před několika málo lety. Naše skupina se zabývá čtením, odborně řečeno sekvenováním, těchto genomů. Genomy nám m.j. vypovídají, v jakých podmínkách jsou schopny přežívat mikroorganizmy nebo co je příčinou schopnosti patogenů způsobit infekci svého hostitele. Přečtení genomu člověka pomohlo pochopit příčinu mnoha dědičných chorob a onkologických onemocnění. V naší laboratoři porovnáváme hladinu „exprese“ genů, především onkogenů z lidských nádorů. To nám pomáhá zjistit porušené signální a regulační dráhy určitého nádoru. Přesná molekulární charakteristika daného nádorového onemocnění je předpokladem účinné cílené terapie. Z genomů mnohobuněčných organizmů se dovídáme mnoho o jejich vývoji, fylogenezi i ontogenezi. Evoluční historii studujeme čtením a porovnáváním genomů zástupců významných živočišných kmenů. V současnosti studujeme genomy několika druhů žahavců, mezi nimi sladkovodní i mořské medůzky, mořské sasanky a také měkké korály. Právě kmen žahavců je z hlediska evoluce velmi důležitý, protože svou stavbou těla představuje unikátní vývojovou větev vyšších živočichů. Odd. genomové integrityVedoucí prof. Jiří BartekGenetická informace buňky je zapsána v molekulách DNA; souborně ji nazýváme buněčný genom. Fyzikální a chemické vlivy vnějšího prostředí, ale i vlastní metabolismus buňky, DNA neustále poškozují. Informace kódovaná v genomu je tak narušována, dochází k chybám a tyto, pokud nejsou opraveny, mají za následek poruchy funkce buněk, tkání a celého organismu. Opravné mechanismy DNA jsou sice velmi výkonné, ale ne stoprocentně účinné. Tak dochází během života organismu k postupnému hromadění chyb, které pozorujeme jako projevy stárnutí organismu, včetně chorob spojených se stárnutím. Mezi takové choroby patří i většina případů zhoubného bujení. Poškozená buňka reaguje obvykle tak, že zpomalí či zastaví buněčné dělení, aby opravila poškozenou DNA ještě před tím, než by se chyba mohla přenést do dceřinných buněk. Pokud se jí to nepodaří, je normální odpovědí nevratná zástava buněčného dělení, při větším rozsahu poškození smrt buňky. Pokud je některý z mechanismů řídících tyto děje nefunkční, poškozená buňka pokračuje v dělení, hromadí další chyby a tento stav může vyústit v nádorové bujení. Zhoubné bujení patří stále mezi jednu z nejčastějších příčin úmrtí v pokročilém věku. Naše laboratoř se zabývá mechanismy, kterými je udržována stabilita a celistvost genomu, signály regulujícími odpověď buňky na poškození DNA a následky poruch genomu, tj. osudem poškozených buněk. V rámci mezinárodního projektu TRIREME finančně podporovaného Evropskou komisí, kterého se kromě naší laboratoře účastní vědecké týmy z Izraele, Velké Británie, Švýcarska a Německa, se snažíme pomocí nejpokročilejších technologií a přístupů popsat co nejdetailněji odpověď buňky na poškození DNA vyvolané ionizujícím zářením, tj. na všech úrovních buněčné organizace, a ze získaných dat za pomoci nově vyvíjených počítačových nástrojů vytvořit pro vědeckou veřejnost široce dostupný model reprezentující na molekulární úrovni pochody v buňce, které probíhají v reakci na tento nejzhoubnější typ poškození DNA. Snažíme se rovněž zjistit, jakým mechanismem se z normální buňky stává nádorová a pochopit, jakým způsobem některé látky brání růstu nádorových buněk. Věříme, že pochopení těchto dějů napomůže najít nové účinnější protinádorové látky s menšími nežádoucími vedlejšími účinky. Odd. imunobiologieVedoucí dr. Dominik FilippÚlohou imunitního systému je nejen ochrana rostlin a živočichů před mikroby a viry vyvolávající infekční onemocnění, ale i jeho přímá účast v procesech ovlivňujících vznik neinfekčních onemocnění. V tomto směru mnohé vědecké pozorování ukazují spojitost nesprávně fungujícího imunitního systému se vznikem rakoviny a autoimunitních chorob, jako je například cukrovka, Crohnovo onemocnění zažívacího traktu či lupénka. Imunitní systém představuje soubor různých typů imunitních buněk, které jsou vybaveny speciálními imunitními zbraněmi proteinové povahy: receptory a molekuly, které příroda vyvíjela a zdokonalovala stovky miliónů let. Tyto molekulární zbraně jsou schopné účinně rozpoznat, usmrtit a odstranit mikrobiální vetřelce ohrožující naše zdraví. Tak jako v každé dobře fungující armádě, tak i v imunitním systému je nejdůležitějším faktorem úspěchu přesná součinnost jednotlivých skupin buněk, ve smyslu jejich posloupnosti a úměrnosti imunitní odpovědi k síle mikrobiálního nepřítele. V případě neúčinné odpovědi na mikrobiální nákazu a nebo na růst nádoru, může dojít k rozsáhlým infekcím či nádorovému bujení, což může vést až ke smrti. Na druhou stranu příliš silná imunitní odpověď může vyvolat poškození vlastní tkáně a autoimunitní onemocnění. Naše laboratoř zkoumá jednak úlohu proteinů, nacházejících se v buňkách imunitního systému, tak i regulační procesy, které koordinují časově-prostorovou sladěnost jednotlivých elementů. Zaměřujeme se na úlohu specializovaných enzymů Lck a Fyn, které jsou důležité pro zahájení imunitní reakce, což v konečném důsledku vede k produkci protilátek a odstranění nežádoucích mikrobů z organismu. Také se zabýváme úlohou specializovaných protimikrobiálních molekul, které jsou schopné velmi účinně usmrtit mikroby i viry a podpořit tak aktivaci imunitního systému. Výsledky našich pokusů však také ukazují, že zvýšené množství těchto látek by mohlo mít za následek iniciaci autoimunitního onemocnění. V tomto ohledu by hladiny protimikrobiálních molekul mohly sloužit jako klinické příznaky pro včasnou diagnózu autoimunitních onemocnění. V neposlední řadě nás též zajímá původ a funkce evolučně nejstaršího typu imunitních buněk, tzv. makrofágů, a jejich úloha spojená s formováním nervové soustavy, a také růstem a dospíváním embrya. Tento projekt je o to zajímavější, že jeho výsledky ukazují na evoluční souvislost imunitních a vývojových procesů, které v konečném důsledku definují biologickou specifičnost každého jedince. Odd. molekulární farmakologieVedoucí dr. Jaroslav BlahošNervové buňky v mozku reagují na na nové informace a ty si předávají mezi sebou pomocí důmyslných signálů, většinou chemických. Tyto signální molekuly se nazývají neuropřenašeče (neurotransmittery). Aby by mohly mezi sebou komunikovat, jeden neuron tyto látky tvoří a další má na svém povrchu molekuly, které tyto neuropřenašeče specificky rozeznávají. Tyto molekuly, zvané receptory, zprostředkují odpověď dané buňky na přítomnost neuropřenašeče. Na našem pracovišti studujeme na molekulární úrovni principy signalizace založené na několika přenašečích - glutamátu, kyselině gamma-aminomáselné (GABA) a tzv. endocannabinoidech. Cílem našeho výzkumu je zjistit, jakým mechanismem tyto neuropřenašeče aktivují příslušné receptory, a jak je možné tuto odpověď regulovat či modulovat pomocí látek, z nichž některé se možná v budoucnu stanou novými léky na některá neurologická onemocnění. Odd. molekulární imunologieVedoucí prof. Václav HořejšíImunitní systém je založen na několika typech bílých krvinek, které jsou schopny rozpoznat, že je v jejich okolí něco v nepořádku, a že je proti možnému nebezpečí potřeba zasáhnout. Buňky imunitního systému rozeznávají potenciální nebezpeží pomocí řady rozpoznávacích molekul na svém povrchu (tzv. receptory). Po navázání nějaké cizorodé látky na příslušný receptor je do buňky předán signál, který může vyvolat patřičnou obrannou reakci (např. produkci protilátek, změnu vlastností buňky („diferenciaci“) tak, aby mohly ničit nebo izolovat vetřelce. Někdy jsou tyto signalizační mechanismy porouchané a fungují buď příliš málo nebo naopak zbytečně intenzivně, což vede k různým chorobám (imunitní nedostatečnosti, alergie, autoimunitní choroby) Naše laboratoř se zabývá molekulárními detaily složitých signalizačních dějů používaných receptory buněk imunitního systému. Objevujeme nové proteinové molekuly, které se signalizace účastní nebo ji regulují. Jako zásadní nástroje pro naši práci používáme tzv. monoklonální protilátky produkované tzv. hybridomovými buňkami, které si v naší laboratoři připravujeme (viz Table). Mnohé z těchto monoklonálních protilátek jsou užitečné i pro praktické účely (např. diagnostika některých typů leukemií). Máme proto úzkou spolupráci s biotechnologickými firmami, které tyto „vedlejší produkty“ našeho základního výzkumu úspěšně komercializují. Odd. molekulární a buněčné imunologieVedoucí doc. Marie LipoldováNa co jsme alergičtí a jaké geny to kontrolují (Vzájemné působení genů a prostředí při vzniku alergických onemocnění) Atopie (nejčastější typ alergie) je náchylnost ke zvýšené produkci imunoglobulinu E (IgE) proti běžným alergenům prostředí, k nimž patří např. pyly, roztoči a plísně. Počet lidí trpících různými atopickými chorobami jako jsou astma, senná rýma a dermatitida celosvětově vzrůstá a nikdo neví proč. Vnímavost k atopickým onemocněním je ovlivněna jak prostředím, tak genetickými faktory, a v různých populacích se liší. V naší laboratoři hledáme geny, které kontrolují vznik atopií u české a ruské populace. Nejdříve jsme určili hlavní alergeny ve skupinách českých a ruských atopických rodin. Tyto výsledky nám umožnují lépe rozdělit naše soubory atopických rodin pro další genetický výzkum a mají i význam pro zlepšení léčby a prevence u sledovaných atopiků. Ke genetickým studiím používáme speciální genetický model tzv. rekombinantních kongenních kmenů myší. Na základě podobnosti myšího a lidského genomu je možné zmapovat kontrolní gen u myši, a pak nalézt gen se stejnou funkcí u člověka. našich experimentech jsme zmapovali jsme 9 míst v genomu které kontrolují hladinu IgE v séru po infekci parazitem Leishmania major. Je zajímavé, že sedm z těchto míst bylo mapováno do úseků obdobných lidským chromosomálním úsekům, které kontrolují hladinu celkového IgE v lidských atopických onemocněních. Genetická analýza u myši může tedy pomoci v těchto úsecích identifikovat neznámé geny, které kontrolují atopické choroby. Genetika vnímavosti k infekčním chorobám Choroby kontrolované mnoha geny s relativně slabým účinkem jsou zodpovědné za velkou část lidských chorob. Sem patří např. většina kardiovaskulárních onemocnění i 90% případů rakoviny. Typickým příkladem takového geneticky podmíněného infekčního onemocnění je leishmaniáza. Tato choroba působená parazity rodu Leishmania, které napadají makrofágy obratlovčího hostitele. Projevy onemocnění se mohou měnit od lokalizovaných kožních lezí po životu nebezpečné napadení vnitřních orgánů. naše laboratoř využívá ke studiu genetických aspektů tohoto onemocnění originálního modelu tzv. rekombinantních kongenních myší, což jsou kmeny, které se vzájemně liší jen v malém počtu genů. Našli jsme řadu míst v myším genomu, které podmiňují vnímavost k tomuto parazitárnímu onemocnění a v současné době se snažíme přesně identifikovat příslušné geny. Několik z genomových oblastí, které kontrolují odpověď k leishmaniáze, pravděpodobně ovlivňuje také vnímavost k dalším infekcím, což naznačuje, že jejich charakterizace přispěje k obecnému pochopení vnímavosti k infekčním chorobám. Odd. molekulární virologieVedoucí dr. Michal DvořákVznik zhoubného nádoru je podmíněn určitými genetickými změnami, které postiženým buňkám vnutí abnormální růst a vývoj. Pro rozvoj nádoru jsou neméně významné i změny v jeho nejbližším okolí, které nádorové buňky podporují. V naší práci se opíráme o známou pravdu, že detailní pochopení problému usnadní jeho řešení. Proto zkoumáme na experimentálně vyvolaných nádorech některé geny, jejichž změny navozují nádorové vlastnosti buněk. Zkoumáme také vzájemné vztahy buněk s jejich nejbližším okolím v těle. Protože je známo, že geny vyvolávající za určitých okolností vznik nádorů mají často významnou roli v normálním vývoji embrya, studujeme ve spolupráci s kolegy embryology regulaci embryonálního vývoje. Naše spolupráce se specialisty na syntézu organických sloučenin je zaměřena na hledání nových látek, použitelných k ničení nádorových buněk pomocí slibné neinvazivní metody – fotodynamické terapie. Rozvíjíme i spolupráci s klinickými onkology, která je motivována přesvědčením, že společně můžeme získat poznatky významné pro porozumění vzniku a růstu lidských nádorů i pro jejich potlačování. Odd. myší molekulární genetikyVedoucí prof. Jiří ForejtStudium lidských aneuploidních syndromů na myším modelu. Laboratoř myší molekulární genetiky se účastní spolupráce s šestnácti prestižními pracovišti v Evropě na společném projektu ANEUPLOIDY, jehož cílem je objasnění vlivu nerovnováhy genové dávky na lidské zdraví. Prototypem takové poruchy je nadpočetná kopie (trisomie) lidského chromosomu 21, známá jako Downův syndrom. Příspěvkem pražského pracoviště je vytvoření myši, která nese nadpočetný úsek chromosomu 17 obsahujícím 300 genů. Tyto myši vykazují s Downovým syndromem některé společné rysy, jako jsou poruchy růstu, kognitivních funkcí a častější výskyt leukemií. Ke studiu funkce normálních a nadpočetných genů v různých tkáních a v různých obdobích vývoje jsou užívány nejmodernější metody molekulární genetiky a genomiky včetně technologie DNA čipů. Projekt je podporován 6. rámcovým programem EU a Grantovou agenturou České republiky. Strnad, P., Blatný, R. Conte, N., Bradley, A., Bureš, J., Forejt. J.: Segmental trisomy of Chromosome 17 – a new model of human aneuploidy syndromes. Proc. Natl. Acad. Sci. U.S.A.102:4500-4505, 2005) Genetická podstata vzniku nových druhů K tomu,
aby úspěšně vznikl nový
živočišný druh
(aby „z opice vznikl člověk“) je třeba, aby si
malá
skupina jedinců přestala vyměňovat geny s ostatními
příslušníky svého druhu a
jejich
izolace se zachovala desítky, ale spíš
stovky tisíc
let. Časným příznakem takové
reprodukční
izolace je neplodnost hybridů mezi nově
vznikajícím
druhem a jeho původní rodičovskou formou. Před lety se
laboratoři myší molekulární
genetiky podařilo
jako první na světě nalézt gen, který
kontroluje hybridní sterilitu u obratlovců, gen Hybrid
sterility 1
myši Mus
musculus.
Přesné molekulární
mapování genu
v myším genomu jsme potvrdili
„vyléčením“
původně sterilních myší
poté, co jsme do
jejich genomu vnesli úsek DNA s
„plodnou“ variantou genu
Hybrid
sterility 1.
Další genetická a
molekulární analýza
mechanismu hybridní sterility ukazuje do důležitou roli
pohlavního X chromozomu při vzniku nových druhů a
na
překvapivou souvislost s neplodností (u
myší i u
člověka) působenou chromozomálními translokacemi.
Nový
myší model pro studium dědičnosti
komplexních
biomedicínských znaků. (Gregorová, S., Divina, P., Storchova, R., Trachtulec, Z., Fotopulosova, V., Svenson, K.L., Donahue, L.R., Paigen, B., Forejt, J.: Mouse consomic strains: Exploiting genetic divergence between Mus m. musculus and Mus m. domesticus subspecies. Genome Res, in press) Odd. nádorové imunologieVedoucí dr. Milan Reiniš Růst
nádorů, zvláště virového
původu, je spojen
se vznikem
protinádorové imunitní
odpovědi.
Tato imunita však nebývá dostatečně
silná,
aby zabránila růstu nádorů. To je dáno
mnoha
faktory. Imunitní systém
nedostává při
interakci s rostoucími nádory
všechny potřebné
aktivační signály, aby došlo k
efektivní
protinádorové imunitní odpovědi a
také
nádorové buňky nejsou
rozpoznávány jako
skutečně „cizí“.
Dalším problémem je, že
nádorové buňky jsou geneticky velmi
nestálé
a tak není divu, že pod tlakem imunitní odpovědi
jsou
selektovány takové varianty, které
jí
uniknou. V neposlední řadě přítomnost
nádoru
vede k aktivnímu potlačení
imunitní
odpovědi. K tomu jsou využity kontrolní mechanismy,
které normálně organismus
chrání před
nekontrolovanými imunitními odpověďmi.
Možnosti
využití imunoterapie nádorových
onemocnění
nebo vakcinace proti nádorům jsou intenzivně
studovány
a navzdory úspěchům při léčbě
experimentálních
nádorů na zvířecích modelech, nejsou
výsledky
klinických studií zatím
příliš
přesvědčivé a úspěchů se dosahuje pouze u
malého
procenta pacientů. Proto je nutný
další základní
výzkum v této oblasti , aby bylo možno
lépe
porozumět dějům, které ovlivňují vznik a
účinnost
imunitní odpovědi proti nádorům a
nových
poznatků využít při přípravě vakcín a
optimalizaci imunoterapeutických postupů.
V naší
laboratoři se zabýváme
základním
výzkumem mechanismů, kterými
nádorové
buňky unikají imunitní odpovědi, a to na modelu
nádorů vyvolávaných lidským
papillomavirem HPV16, který je odpovědný za
nádory
děložního čípku. Naším
cílem je
zjistit, zda a jakým způsobem je možno znovu navodit imunitu
proti nádorům, které již nějakým
způsobem
imunitě unikly. Dalším tématem je
charakterizace
jednotlivých buněčných populací,
které
hrají roli v potlačení
protinádorové
imunity. Chceme zjistit, jakým způsobem spolu
komunikují
a jak je možno eliminovat jejich negativní účinky. Získané poznatky mohou být využity pro optimalizaci experimentálních terapeutických postupů. Vzhledem k tomu, že imunoterapie by měla být kombinována se stávajícími standardními léčebnými postupy vedoucími ke zmenšení masy nádoru a případně by měla být využita pro eliminaci mikroskopických a delokalizovaných zbytků nádoru, zvláštní pozornost věnujeme problémům léčby zbytkové nádorové choroby po chirurgickém odstranění nádoru nebo chemoterapii. Odd. signální transdukceVedoucí dr. Petr DráberPracoviště se zabývá především objasňováním molekulárních mechanismů vedoucích např. k některým imunitním obranným reakcím, ale i k alergickým reakcím. Tyto reakce jsou založené hlavně na specializovaných typech bílých krvinek zvaných žírné buňky a bazofily. Ty mají na svém povrchu receptory, které prostřednictvím imunoglobulinu E (IgE) váží cizí látky/alergeny. Po navázání na tyto receptory se spouští signalizační mechanismy, které nakonec vedou k tomu, že se z buňky začnou uvolňovat biologicky velmi účinné látky (např. histamin), které jsou zodpovědné za známé alergické projevy (např. zarudnutí kůže a dýchací problémy). Laboratoř se snaží zmapovat všechny molekuly, které se zúčastní těchto aktivačních dějů a zjistit jaké role v těchto složitých procesech hrají. Výsledky tohoto výzkumu jsou důležité pro pochopení vzniku alergií a zánětlivých procesů a hlavně pro poznání možností racionálních léčebných zásahů do těchto složitých dějů. Odd. transkripční regulaceVedoucí dr. Zbyněk KozmikZrak je velmi důležitým smyslem většiny živočichů, včetně lidí. Přitom genetický původ a evoluce oka nejsou ještě zdaleka objasněné. Tato okolnost trápila již zakladatele evoluční teorie Charlese Darwina, který se problému evoluce oka věnoval ve svém klíčovém díle "O původu druhů". V přírodě je možné pozorovat neuvěřitelně pestrou škálu různých typů očí. Je téměř neuvěřitelné, že za vznik nejroztodivnějších druhů očí obratlovců i bezobratlých jsou často zodpovědné stejné geny. V našem oddělení používáme pro studium vzniku a vývoje očí moderní metody molekulární, buněčné a vývojové biologie a genetiky. Evoluci a embryonální vývoj oka zkoumáme převážně na modelech myši, kopinatce a medúzy. Naše výsledky pomohou objasnit evoluci oka jako orgánu zraku a také přispět k porozumění vzniku genetických poruch zraku u člověka. Odd. transplantační imunologieVedoucí doc. Vladimír HoláňPracovníci této laboratoře se zabývají možnostmi regulací nežádoucích imunitních reakcí namířených proti transplantátům. Na experimentálních modelech transplantace kůže a oční rohovky jsou testovány nové optimální léčebné přístupy k dosažení dlouhodobého přežívání geneticky odlišných tkání. Cílem je nalézt postupy, při kterých by nebylo nutno po transplantaci dlouhodobě používat imunosupresivní léky, které u pacientů vyvolávají nepříznivé vedlejší účinky (celkové snížení imunity). Kromě buněk, které obranné imunitní reakce zprostředkovávají (ale které také odhojují transplantáty nebo vyvolávají škodlivá autoimunitní a alergická onemocnění), existují v organismu i buňky, které imunitní reakce tlumí. V naší laboratoři se zabýváme také těmito tlumivými (regulačními) buňkami, které by mohly významně pomoci v potlačování nežádoucích odhojovacích transplantačních reakcí. Jelikož při silném poškození oka nemusí být transplantace rohovky vždy dostatečná k úplné obnově vidění, zavádíme také experimentální modely transplantace tzv. limbu. Limbus je velmi malá část oka na okraji rohovky, ve které sídlí tzv. kmenové buňky, z nichž se rohovka vytváří. V současné době tyto kmenové buňky úspěšně kultivujeme, charakterizujeme a připravujeme jejich přenosy na nosičích z nanovláken. Tyto postupy by v budoucnu mohly vést k efektivní léčbě poškozeného povrchu oka nebo vrozených vad vidění. Laboratoř strukturní biologieVedoucí dr. Pavlína ŘezáčováNaše laboratoř strukturní biologie se zabývá určováním trojrozměrných struktur široké škály bílkovin a jejich komplexů, a to pomocí metod proteinové krystalografie. Molekuly bílkoviny uspořádané do pravidelného krystalu jsou vystaveny velice intenzivním paprskům rentgenového záření (o vlnové délce kolem 10-10 m). Z toho, jakým způsobem dochází k rozptylu rentgenového záření krystalem lze pomocí matematických metod zrekonstruovat struktury molekul tvořících krystal. Informace o trojrozměrné struktuře je nezbytná k pochopení funkce bílkoviny, jejích vlastností a může též být využita při návrhu nových léčiv. Příkladem takových bílkovin, kterými se oddělení v současnosti zabývá, jsou proteáza (enzym štěpící bílkoviny) z viru HIV, potenciální léčebné monoklonální protilátky a některé bílkoviny charakteristické pro lidské nádory (galektin 4 a karbonická anhydráza 9). 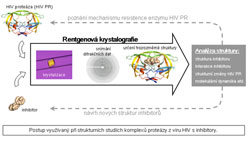
|
| Webmaster | © UMG |