K dalším možným cestám, jak bojovat s alergiemi a jinými nebezpečnými zánětlivými stavy, přispěl výzkum vědců z oddělení biologie cytoskeletu a oddělení signální transdukce Ústavu molekulární genetiky AV ČR, který ukazuje na nové zásahové místo pro potenciální léčbu těchto onemocnění. Badatelům se podařilo prokázat, že aktivace žírných buněk vede k tvorbě doposud nepopsaných mikrotubulárních výběžků, a na molekulární úrovni objasnit, jak tyto výběžky vznikají. Klíčovou roli mají výrazné změny ve vnitrobuněčné koncentraci vápenatých iontů.

Foto: Stanislava Kyselová, Akademický bulletin
Žírné buňky patří mezi buňky imunitního systému, které jsou iniciátory zánětlivých a alergických reakcí, astmatu nebo anafylaxe. Významnou roli hrají také při vzniku autoimunitních chorob, jako jsou revmatická artritida nebo roztroušená skleróza. Nacházejí se roztroušeně v mnoha tkáních v našem těle, nejvíce ale v kůži a v trávicím traktu. Za normálních okolností napomáhají likvidaci patogenů, např. bakterií. Pro tuto funkci jsou vybaveny na svém povrchu TLR (Toll-like receptory). Tyto buňky mají také receptory pro imunoglobulin E (IgE), které jsou zodpovědné za některé nežádoucí reakce žírných buněk na jinak neškodné látky (alergeny).
Při aktivaci žírných buněk dochází k uvolnění (sekreci) zánětlivých mediátorů z cytoplasmatických váčků do okolí buňky. Mezi tyto mediátory patří tryptáza, histamin, serotonin a heparin. V průběhu aktivace se nově tvoří lipidové mediátory (prostaglandin D2, leukotrien C4) a cytokiny. Agregace IgE receptoru (FceRI) multivalentním antigenem spouští kaskádu biochemických dějů, které vedou k fosforylaci FceRI a mnoha dalších proteinů, zvýšené koncentraci cytoplazmatického vápníku, reorganizaci cytoplazmatických komponent (endoplasmatického retikula, sekretorických váčků), ke změnám v morfologii buňky a dalším pochodům spojených s buněčnou aktivací. Molekulární mechanismy mnoha těchto reakcí nejsou známy. Podrobné mapování časných signálních drah v průběhu aktivačních dějů žírných buněk a jejich vliv na uspořádání buněčného cytoskeletu, trojrozměrné dynamické sítě proteinových vláken, je předmětem společného výzkumu oddělení biologie cytoskeletu a oddělení signální transdukce Ústavu molekulární genetiky AV ČR.

Foto: Z. Hájková, Archiv ÚMG AV ČR
Při aktivaci žírných buněk nastávají rychlé změny v organizaci mikrotubulů. Distribuce mikrotubulů u neaktivovaných (a, c) a aktivovaných (b, d) buněk vizualizovaná imunofluorescenční mikroskopií pomocí specifické protilátky proti a-tubulinu. V horní řadě je pohled na buňky „shora“, mikrotubuly jsou značeny zeleně a jádro modře. Ve spodní řadě je trojrozměrná rekonstrukce mikrotubulů při pohledu na buňky v rovině kolmé na rovinu buněčné adheze (pohled ze strany). Měřítko: 10 mm.
Předchozí experimenty prokázaly, že při aktivaci se reorganizují mikrotubuly – významná složka cytoskeletu. Molekulární mechanismy, které kontrolují změny v organizaci mikrotubulů během aktivačních dějů, však nebyly doposud popsány. Mikrotubuly jsou trubičkové útvary o vnějším průměru kolem 25 nm, které se vyskytují u všech eukaryontních buněk. Bývají zakotveny v organizačních centrech mikrotubulů (centrozomech) a směřují u buněk v interfázi k plazmatické membráně. Jde o dynamické struktury, které vznikají polymerací dimerů a- a ß-tubulinu a účastní se mnoha základních buněčných funkcí, jako jsou udržování tvaru buňky, vnitrobuněčný transport, přenos signálů a dělení buněk. V odpovědi na signály z vnějšího prostředí mohou mikrotubuly růst nebo naopak rychle depolymerovat. Při polymeraci mikrotubulů se na jejich rostoucím konci koncentrují proteiny, které usnadňují přidávání tubulinových dimerů z cytoplazmy. Jedním z typických „markerů“ rostoucích mikrotubulů je protein EB1 (End-binding protein 1). Sledováním distribuce značeného EB1 v živých buňkách časosběrnou kinematografií je možné určit dynamické parametry mikrotubulů v aktivovaných buňkách.
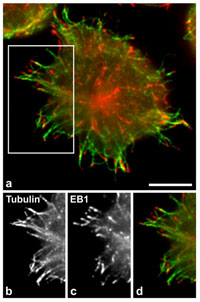
Foto: Z. Hájková, Archiv ÚMG AV ČR
Při aktivaci žírných buněk se zvětšuje počet rostoucích mikrotubulů. Imunofluorescenční lokalizace proteinu EB1, který představuje marker rostoucích mikrotubulů u aktivovaných žírných buněk. EB1 protein je značen červeně, mikrotubuly zeleně (a). Ve spodní části obrázku je detail periferie buňky s mikrotubuly (b) a proteinem EB1 (c). V barevném panelu (d), který ukazuje spojení obrázků (b) a (c), jsou mikrotubuly značeny zeleně a EB1 protein červeně. Měřítko: 10 mm.
Vědcům z ÚMG AV ČR se podařilo prokázat, že při aktivaci žírné buňky se na celém jejím povrchu tvoří doposud nepopsané výběžkové útvary, které obsahují mikrotubuly. Tvorba těchto mikrotubulárních výběžků je závislá na enzymové aktivitě protein tyrosinových kináz Src rodiny a na zvýšené koncentraci cytoplazmatického vápníku. Důležitou roli v tomto procesu hraje protein STIM1 (Stromal Interaction Molecule 1). Tento protein je citlivým senzorem koncentrace vápníku v endoplazmatickém retikulu a jednou z ústředních komponent regulující otevírání iontových kanálů na plazmatické membráně. STIM1 svou aktivitou reguluje tok Ca2+ z extracelulárního prostoru do nitra buňky. Pro studium byly využity nové mikroskopické techniky, zejména TIRF (Total Internal Reflection Fluorescence) mikroskopie; ta umožňuje sledovat mikrotubuly v oblasti 100 nm pod plazmatickou membránou. Tyto techniky v kombinaci s časosběrnou kinematografií dovolily sledovat změny mikrotubulů v čase. U buněk exprimujících protein EB1 označený zelenou značkou EGFP (Enhanced Green Fluorescent Protein) se po-dařilo prokázat, že se po aktivaci velmi rychle objevují mikrotubuly se zvýšenou rychlostí polymerace, a že se tvoří mikrotubulární výběžky. U buněk se sníženou expresí STIM1 proteinu se rychlost polymerace mikrotubulů naopak snížila a byla inhibována i tvorba mikrotubulárních výběžků. Tato inhibice byla zrušena, pokud byla hladina STIM1 proteinu v buňkách obnovena. Další experimenty prokázaly, že deplece STIM1 ovlivnila také uvolňování zánětlivých mediátorů z cytoplazmatických váčků a pohyblivost buněk při chemotaxi.
Získané výsledky představují první důkaz regulační úlohy STIM1 proteinu při polymerizaci mikrotubulů a ukazují, že vnitrobuněčná koncentrace Ca2+ hraje klíčovou roli v regulaci těchto cytoskeletálních struktur při buněčné aktivaci. Mikrotubulární výběžky by mohly sloužit jako senzory chemotaktických gradientů antigenů nebo jiných signálních molekul, s nimiž se žírné buňky setkávají v místech zánětu. V současné době pokračují experimenty s cílem blíže objasnit molekulární mechanismus působení vápníku na dynamiku mikrotubulů.

Foto: Stanislava Kyselová, Akademický bulletin
Dosažené výsledky jsou důležité nejen k pochopení úlohy buněčného cytoskeletu při buněčné aktivaci a propagaci vnitrobuněčných signálů, ale také z hlediska nových strategií léčby alergií a jiných zánětlivých stavů. Pokud se prokáže, že tvorba mikrotubulárních výběžků je důležitá pro sekretorické funkce žírných buněk také v podmínkách in vivo, dá se předpokládat, že aplikace látek ovlivňujících dynamiku mikrotubulů potlačí nežádoucí funkce žírných buněk. Dosavadní experimenty badatelé dělali na myších buňkách. Dalším krokem je ověření výsledků na liniích lidských žírných buněk, které se podařilo na ÚMG AV ČR ustanovit v letošním roce. Dílčí etapy tohoto výzkumu jsou v současné době součástí projektu evropské spolupráce COST (Co-operation in Scientific and Technical research) Action BM1007, Mast cells and basophils-targets for innovative therapies.
Detailní informace naleznete v publikaci Hájková Z., Bugajev V., Dráberová E., Vinopal S., Dráberová L., Janáček J., Dráber Pe., Dráber Pa.: STIM1-directed reorganization of microtubules in activated mast cells. J. Immunol. 186: 913–923, 2011.
PAVEL DRÁBER a PETR DRÁBER,
Ústav molekulární genetiky AV ČR, v. v. i.













 Česky
Česky
