|
|
Vedoucí: Prof. RNDr. Vladimír Holáň, DrSc.E-mail: holan@biomed.cas.cz |
Oddělení je zaměřeno především na studium buněčných a molekulárních mechanismů specifické transplantační imunity a na využití získaných poznatků pro regulace imunitních reakcí s cílem zlepšení přežíváni geneticky odlišných transplantátů buněk a tkání. Základní model představují kultivované a cíleně diferenciované kmenové buňky (mesenchymální, limbální), které jsou přenášeny pomocí různých typů nanovlákenných nosičů za účelem reparace těžkých poškození kůže, očního povrchu a deficience limbálních kmenových buněk. Je využito široké spektrum metod buněčné a molekulární biologie, jako jsou tkáňové kultury, diferenciace kmenových buněk, studium regulace genové exprese (PCR, real time PCR), produkce a detekce cytokinů (ELISA, ELISPOT), průtoková cytometrie, MACS, Western blotting, experimentální modely transplantace kůže, oční rohovky, limbu a přenosy kmenových buněk. Hlavním cílem je testování získaných poznatků v preklinických modelech a jejich potenciální využití v klinické praxi (především u pacientů s těžkými poraněními očního povrchu).
|
Vědečtí pracovníci: Prof. RNDr. Vladimír Holáň, DrSc. RNDr. Alena Zajícová, CSc. RNDr. Magdaléna Krulová, Ph.D.
PhD studenti: Mgr. Eliška Javorková Ing. Milada Chudičková Mgr. Peter Trošan Mgr. Michaela Pavlíková
Pregraduální studenti: Pavla Boháčová Jan Kössl
Laboranti/technický personál: Lucie Holáňová Jaroslava Knížová |
Témata výzkumu
Transplantace orgánů nebo přenos kmenových buněk představují často jedinou možnost léčby pro zlepšení kvality života nebo dokonce pro jeho záchranu. Hlavní překážku v další rozvoji léčebných transplantací však představuje imunitní reakce proti cizím antigenům na transplantovaných buňkách. Proto je hlavním cílem našeho výzkumu získání nových a hlubších znalostí o buněčných a molekulárních mechanismech odhojovací imunitní reakce a hledání nových cest k cíleným imunoregulacím. Na modelu studie imunity v oku jsme ukázali, že úspěšná léčba vážně poškozeného očního povrchu vyžaduje přenos limbálních kmenových buněk, které regeneraci rohovky zajišťují. Proto je součástí našeho výzkumu studium kmenových buněk, které by mohly podporovat regeneraci očního povrchu a tak se podílet na zlepšení schopnosti vidět. V současné době jsme schopni úspěšně izolovat limbální nebo mezenchymální kmenové buňky a tyto buňky využít pro léčbu poškozeného rohovkového epitelu. Pro přenos těchto buněk na poškozený povrch oka úspěšně využíváme různé typy nanovlákenných konstruktů. Tyto nosiče vytvářejí optimální 3D strukturu vhodnou pro růst a přenos kmenových buněk. Naším hlavním cílem je poznání a využití mechanismů specifické imunitní reakce a také isolace, kultivace a následná transplantace ex vivo namnožených kmenových buněk a navržení a charakterizace nových postupů pro cílené imunoregulace umožňující přežívání geneticky odlišných buněk a orgánů.
Současné experimenty jsou také zaměřeny na studium možností cílené diferenciace mesenchymálních kmenových buněk v buňky poškozené tkáně a na jejich využití pro regeneraci poškozeného povrchu oka. Tento model představuje jednu z mnoha možností využití cíleně diferenciovaných kmenových buněk pro transplantace v regenerativní a reparativní medicíně.
|
Obr. 1: Experimentální model transplantace kůže u inbredních kmenů myší. Kožní alotransplantáty jsou po 10 dnů chráněny protektivními obvazy a po jejich odstranění je sledováno a vyhodnocováno přežívání transplantátů u různě léčených příjemců.
|
|
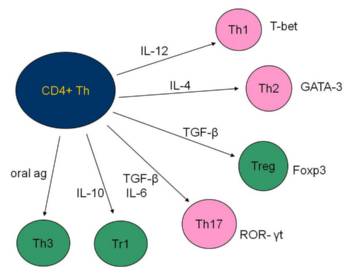
Obr. 2: Schéma regulační role cytokinů při vývoji fenotypově a funkčně odlišných subpopulací T lymfocytů.
|
|
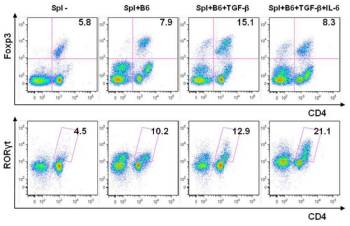
Obr. 3: Studium in vitro indukce a vývoje regulačních T lymfocytů a prozánětlivých Th17 buněk pomocí průtokové cytometrie (FACS). Slezinné buňky z BALB/c myší byly kultivovány s ozářenými buňkami z B6 myší v přítomnosti determinujících cytokinů TGF-ß a IL-6. Procenta regulačních T buněk (Foxp3+ buňky) nebo Th17 buněk (RORγt+ buňky) byla stanovena pomocí FACS analýzy.
|
|
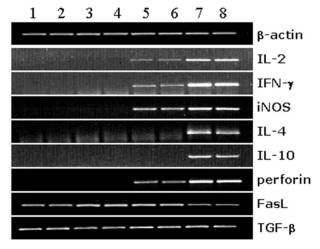
Obr. 4: Exprese genů pro imunologicky významné molekuly v odhojovaném alogenním nebo xenogenním transplantátu rohovky v experimentálním modelu u myši. Exprese genů v individuálních rohovkových transplantátech byla detekována pomocí PCR. Linie 1,2 – kontrolní (netransplantovaná) rohovka, 3,4 - syngenní transplantát rohovky, 5,6 – transplantát alogenní rohovky, 7,8 – xenotransplantát rohovky.
|
Významné výsledky oddělení v roce 2013
1. Regenerace těžce poškozeného povrchu oka pomocí kmenových buněk
Limbální a mesenchymální kmenové buňky byly expandovány in vitro a pomocí nanovlákenných nosičů byly přeneseny na poškozený oční povrch v experimentálních modelech u myši a u králíka. Terapeutický účinek kmenových buněk byl hodnocen histologicky a podle schopnosti kmenových buněk inhibovat expresi genů pro prozánětlivé molekuly jako je IL-2, IFN-gama, IL-17 nebo iNOS. Výsledky ukázaly využitelnostl kmenových buněk a nanovlákenných nosičů pro léčbu těžce poškozeného očního povrchu.
Spolupráce: Evropská oční klinika Lexum, Praha.
|
|
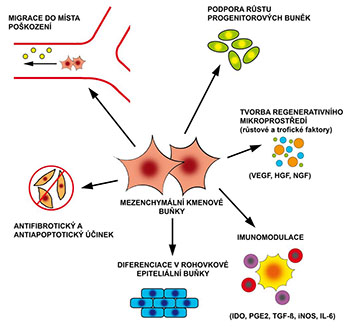
Schéma imunoregulačního a terapeutického působení mesenchymálních kmenových buněk (MSC).
MSC působí řadou odlišných mechanismů. Mezi nejdůležitější patří jejich diferenciace v epiteliální buňky, imunomodulační působení a produkce celé řady růstových a trofických faktorů.
|
|
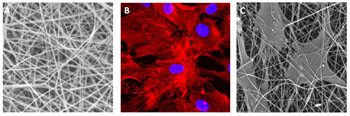
Struktura nanovlákenného nosiče (A) a růst mesenchymálních kmenových buněk na nanovlákenném nosiči (B, C).
(A) Obraz nanovláken ze skenovacího elektronového mikroskopu (SEM), průměr nanovláken je 380 nm. (B) Myší MSC rostoucí na nanovláknech (červeně filamenty – F-aktin barvený falloidinem, modré – buněčná jádra barvená DAPI). (C) SEM obraz myších MSC rostoucích na nanovláknech.
|
|
|
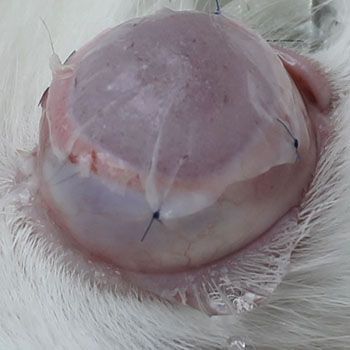
Chemicky poškozené oko králíka pokryté nanovlákenným nosičem s kmenovými buňkami. Přenos nanovlákenného nosiče s kmenovými buňkami na poškozený oční povrch u králíka. |
Publikace:
- Holáň, V., Javorková, E.: (2013) Mesenchymal stem cells, nanofiber scaffolds and ocular surface reconstruction. Stem Cells Rev. Rep. 9(5), 609-619. IF 4.523
- Čejková J., Tošan P., Čejka Č., Lenčová A., Zajícová A., Javorková E., Kubinová Š., Syková E., Holáň V.: (2013) Suppression of alkali-induced oxidative injury to the cornea by mesenchymal stem cells growing on nanofiber scaffolds and transferred onto the damaged corneal surface. Exp. Eye Res. 116, 312-323. IF 3.026
- Holáň, V., Javorková, E., Trošan, P.: The growth and delivery of mesenchymal and limbal stem cells using copolymer polyamide 6/12 nanofiber scaffolds. In: Wright, B. and Connon, C. J. (eds), Corneal Regenerative Medicine, Methods Mol. Biol., Humana Press – Springer, New York, London 2013, S. 187-199. ISBN 978-1-62703-431-9.
2. Role cytokinů při diferenciaci a funkci regulačních T a B buněk.
Bylo prokázáno, že odlišné cytokiny determinují vývoj a funkci regulačních T (Treg) a B (Breg) buněk. Zatímco TGF-beta determinuje vývoj a zesiluje imunosupresivní funkce Treg, u B lymfocytů tento cytokin tlumí vývoj Breg produkujících supresivní cytokin IL-10. Naproti tomu jiné dva cytokiny, IL-12 a IFN-gama, vývoj Breg silně zesilují. Výsledky tak ukazují odlišné role cytokinů při vývoji Treg a Breg a naznačují možnosti jejich využití pro efektivnější cílené regulace funkcí imunitního systému.
Spolupráce: Přírodovědecká fakulta UK, Praha
|
|
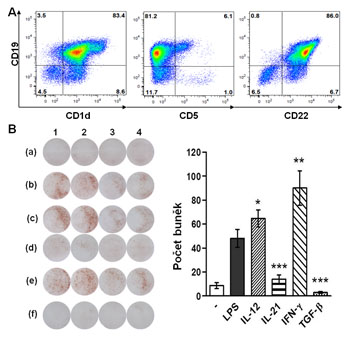
(A) Charakterizace populací B lymfocytů pomocí průtokové cytometrie. (B) Detekce buněk produkujících interleukin-10 pomoci techniky ELISPOT.
|
Publikace:
- Holáň, V., Zajícová, A., Javorková, E., Trošan, P., Chudičková, M., Pavlíková, M., Krulová, M.: (2013) Distinct cytokines balance the development of regulatory T cells and IL-10-producing regulatory B cells. Immunology. In press. IF 3.705
- Kubera M., Curzytek K., Duda W., Leskiewicz M., Basta-Kaim A., Budziszewska B., Roman A., Zajícová A., Holáň V., Szczesny E., Lason W., Maes M.:. (2013) A new animal model of (chronic) depression induced by repeated and intermittent lipopolysaccharide administration for 4 months. Brain Behav. Immun. 31, 96-104. IF 5.612
- Holáň, V., Krulová, M.: (2013) Common and small molecules as the ultimate regulatory and effector mediators of antigen-specific transplantation reactions. World J. Transplant. 3(4), 54-61. (nový časopis, zatím bez IF)