2008
|
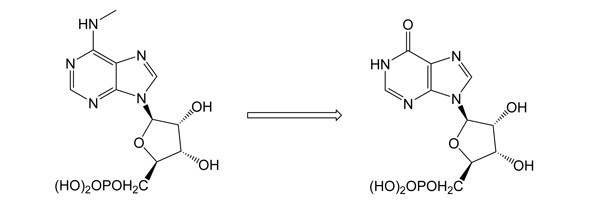
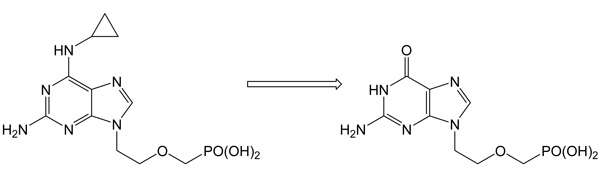
N6-Methyl-AMP-aminohydrolasa: klíčový enzym intracelulární aktivace N6-substituovaných purinových acyklických nukleosidfosfonátůDoposud nepopsaný enzym katalysuje aminohydrolysu přirozených substrátů N6-meAMP, N6,N6-dimethyl-AMP and N6-medAMP na IMP nebo dIMP. Kromě své přirozené metabolické funkce, N6-methyl-AMP-aminohydrolasa aktivuje profarmaka N6-substituovaných acyklických nukleosidfosfonátů, potenciálních antivirotik a antileukemických agens. Příkladem je deaminace N6-cyklopropyl-2,6-diamino-9-[2-(fosfonomethoxy)ethyl]purinu (cyprPMEDAP), intracelularního metabolitu antileukemické látky GS-9219 na aktivní nukleotidový analog 9-[2-(fosfonomethoxy)ethyl]guanin (PMEG).
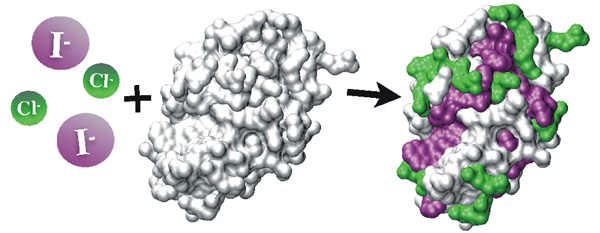
Associace proteinů v solných roztocích: Molekulární porozumění Hofmeisterově řadě120 let poté, co Franz Hofmeister (na Farmakologickém ústavu v Praze) seřadil ionty solí podle jejich schopnosti vysolovat bílkoviny, současné simulace molekulové dynamiky poskytují klíč k porozumění lyotropní (Hofmeisterovy) řady na molekulové úrovni. Pomocí simulací interakcí mezi proteiny ve vodných roztocích alkalických halidů jsme ukázali, že řazení iontů ovlivňuje ne jeden, ale řada různých efektů. Ve skutečnosti jsme pro modelový případ asociace molekul lysozymu jasně pozorovali přinejmenším dva takové efekty. Jde o přímou interakci mezi vodnými anionty s pozitivně nabitými postranními řetězci aminokyselin a afinita těchto iontů k hydrofóbním částem povrchu bílkoviny. Zatímco první interakce jsou silnější pro chlorid než pro iodid, opak je pravdou pro druhý efekt. Pro studovaný případ hydrofóbní efekt iodidu vyhrává nad iontovým párováním chloridu, což vede k silnější asociaci molekul lysozymu ve vodném roztoku NaI než NaCl. Tyto výsledky, podporované experimenty, mají důsledky nejen pro precipitaci proteinů, ale také pro další iontově specifické efekty pro proteiny, jako krystalizace, denaturace a enzymatická aktivita.
Lund M., Jungwirth P., Woodward C.E.:
Lund M., Vácha R., Jungwirth P:
Molekulární charakterizace nového typu antivirové resistence u HIV positivních pacientůInhibitory virové proteasy jsou často a úspěšně užívanými léky proti AIDS. Významnou komplikací úspěšné léčby je vývoj virové resistence. Pod selekčním tlakem inhibitorů se totiž velmi rychle objevují virové mutanty, které vůči příslušným látkám už nejsou citlivé. Většina mutací v HIV protease, které vedou k vývoji resistence, spočívá v záměně jedné nebo více aminokyselin v okolí vazebného místa pro inhibitor. Nedávno však byly popsány mutace zcela nového typu, spočívající v inserci (vložení ) jedné nebo více aminokyselin do sekvence virové proteasy. Žádný takový enzym však dosud nebyl naklonován a ani nebyla charakterisována resistence nebo její mechanismus na molekulové úrovni. Ve spolupráci s kolegy z Universitního lékařského centra v Utrechtu jsme naklonovali dvě proteasy obsahující aminokyselinové inserce, pocházející z holandského pacienta dlouhodobě léčeného inhibitory virové proteasy. Tyto enzymy jsme připravili rekombinantní expresí v E. coli, plně jsme je enzymologicky charakterisovali, spolu se skupinou Pavlíny Řezáčové jsme vyřešili jejich strukturu rentgenovou difrakcí a navrhli mechanismus, jakým aminokyselinové inserce mohou způsobit vznik resistence proti inhibitorům proteasy u HIV. Jedná se o první práci tohoto druhu v literatuře.

|