Transportéry patogenních kvasinek jako cíl nových léčiv
Patogenní kvasinky rodu Candida mají ve svých membránách některé transportéry, které se svou strukturou a aktivitou liší od transportérů v buňkách hostitelského organismu. Tyto transportéry se tak mohou stát cílem působení nových typů léčiv, které poškodí buňky kvasinek, ale ne buňky hostitele.
Z více než 1400 známých druhů lidských patogenů tvoří houbové a kvasinkové mikroorganismy 22 % a jsou tak druhou nejpočetnější skupinou po bakteriích (38 %). Kvasinky rodu Candida patří mezi nejčastější původce kvasinkových infekcí. Tyto kvasinky jsou součástí normální lidské mikroflóry, jakmile je však imunitní systém člověka oslaben (např. v důsledku AIDS, transplantací orgánů a kostní dřeně, či léčby rakoviny), stávají se rázem z do té doby komenzálně žijících mikroorganismů patogeny, které dokážou v případě zanedbání léčby člověka i zabít.
Roku 1929 ukázal sir Alexander Fleming objevem penicilinu lidstvu cestu, jak bojovat s bakteriálními infekcemi. Od té doby byla vyvinuta celá kolekce různých antibiotik včetně širokospektrálních. Vývoj antimykotik není zdaleka tak jednoduchý. Kvasinky i lidské buňky jsou eukaryoty fungujícími na velmi podobných principech, na rozdíl od prokaryotních bakterií. Díky této evoluční příbuznosti není snadné vytvořit taková léčiva, která by nezahubila s patogenem i lidského hostitele. Navíc buňky patogenních kvasinek si v průběhu evoluce osvojily řadu způsobů, které jim umožňují přežít v nepříznivých podmínkách a které jim nyní pomáhají k získání odolnosti vůči antimykotikům.
| C. albicans | 42,1 % |
| C. glabrata | 26,7 % |
| C. parapsilosis | 15,9 % |
| C. tropicalis | 8,7 % |
| C. krusei | 3,4 % |
| C. lusitaniae | 1,1 % |
| C. dubliniensis | 0,9 % |
| C. guilliermondii | 0,4 % |
| Ostatní | 0,8 % |
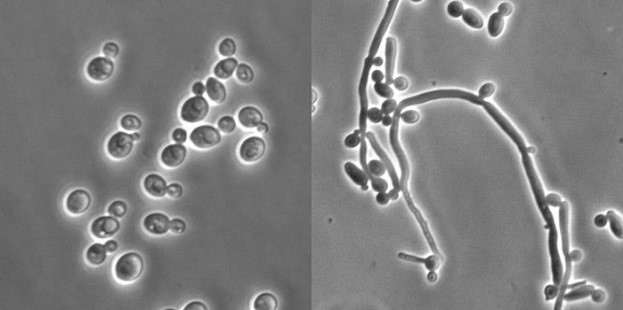
Candida albicans je schopna reverzibilně měnit svou morfologii mezi kvasinkovou (vlevo) a hyfovou formou (vpravo) v závislosti na vnějších podnětech – teplotě, pH, přítomnosti živin, lidských hormonů apod. Zatímco kvasinková forma umožňuje efektivnější šíření C. albicans, hyfová forma je lépe uzpůsobena k pronikání do tkání hostitele a jejich destrukci.
V našem výzkumu patogenních kvasinek se ubíráme dvěma směry:
- Studujeme draselné transportéry v kvasinkách rodu Candida, jež se liší od transportérů draslíku v lidských buňkách, a představují tudíž potenciální cíl nových antimykotik.
- deleci genů kódujících draselné transportéry v kvasinkách rodu Candida
- heterologní expresi transportérů K+ z Candid v kmeni S. cerevisiae, který postrádá své vlastní transportéry K+ (BYT12, trk1∆ trk2∆)

- Snažíme se přispět k řešení lékové rezistence, která v současné době představuje velice závažný medicínský problém především při léčbě mikrobiálních infekcí u pacientů se sníženou imunitou, komplikuje však i léčbu rakoviny. Příčinou mnohačetné lékové rezistence je schopnost buňky aktivně vylučovat léčiva membránovými transportéry – MDR pumpami. Také buňky patogenních kvasinek dokážou efektivně vyloučit látky, které by je mohly poškodit. Řešením problému je vývoj nových léků, které by omezily činnost těchto MDR transportérů. Takovéto inhibitory by bylo možné podávat pacientům spolu s konvenčními léky na léčbu bakteriálních a kvasinkových infekcí či nádorů. V konečném důsledku by kombinovaná terapie mohla vést k používání léků v nižších koncentracích a omezení jejich případných negativních vedlejších účinků.
- primárně aktivní transportéry, nazývané také pumpy, které získávají energii z hydrolýzy ATP a řadí se do rodiny ABC proteinů, jež obsahují tzv. ATP-vazebnou kazetu (ATP-binding cassette);
- sekundárně aktivní transportéry, které využívají elektrochemického gradientu protonů nebo sodných iontů přes membránu. Tyto proteiny, patřící do rodiny PMF, přenášejí molekuly cizorodých látek ven z buněk a současně H+ (Na+) do buněk.

© 2014 Fyziologický ústav AV ČR




