2011
|
Krystalová struktura monomeru retrovirové proteasy vyřešená bezprecedentním způsobemRetrovirové proteasy, které jsou nezbytné pro vznik infekčního viru, jsou aktivní ve formě homodimeru. Dosavadní inhibitory proteas, které jsou používány v klinické praxi, inhibují pouze dimerní formu proteasy. Atraktivním přístupem by bylo zabránit vzniku dimeru proteasy inhibitory dimerizace. Takové inhibitory však nejsou doposud k dispozici. Retrovirus M-PMV, který napadá makaky a způsobuje u nich syndrom podobný AIDS (SAIDS) je vhodným modelem pro vývoj léků proti AIDS. Biochemické a NMR studie ukázaly, že proteasa retroviru M-PMV se může unikátně sbalit ve formě monomeru. Pro určení krystalové struktury byl připraven mutant proteasy, u kterého nedocházelo k degradaci při přípravě krystalů. Krystalová struktura monomeru proteasy však nešla vyřešit pomocí běžných metod molekulárního nahrazení. Po mnoha letech úsilí řešení přineslo až vytvoření modelu proteasy hráči internetové hry Foldit pomocí programu mr-rosetta na sociální síti. Na základě modelu vytvořeného hráči byla vyřešena krystalová struktura monomeru proteasy, která poskytuje informace pro výchozí návrh dimerizačních inhibitorů retrovirových proteas.

extrahovaná z dimerní formy proteasy. "Flap" označuje záklopku - smyčku, která má u M-PMV zcela neočekávaný tvar, který nejprve vytvořili hráči Folditu a který byl potvrzen i v krystalové struktuře.
Nature Structural and Molecular Biology 18: 1175-1177 (2011).
Gilski M., Kazmierczyk M., Krzywda S., Zábranská H., Cooper S., Popovic Z., Khatíb F., Dímaio F., Thompson J., Baker D., Pichová I., Jaskolski M.:
Inhibice trávicího enzymu parazitické krevničky jako cesta pro léčbu schistosomózySchistosomóza (bilharzióza) je chronické infekční onemocnění způsobené krevničkami rodu Schistosoma. Tyto parazitické motolice, které infikují přes 200 milionů lidí v tropických a subtropických oblastech, jsou globální zdravotní problém. V současnosti je dostupný jediný lék proti schistosomóze a hrozba vzniku rezistence vyžaduje hledání nových účinných chemoterapeutik. Dospělé krevničky žijí v cévách hostitele a jejich hlavním potravním zdrojem jsou proteiny přijaté z krve. Klíčovou úlohu při trávení proteinů ve střevě krevničky hraje proteolytický enzym katepsin B1 (SmCB1), který tak představuje vhodnou cílovou molekulu pro terapeutický zásah. Pomocí rentgenové krystalografie jsme vyřešili první prostorovou strukturu SmCB1 a to ve formě komplexů s peptidomimetickými inhibitory (viz obrázek). Funkční biochemická analýza umožnila popsat vztahy mezi strukturou SmCB1, enzymovou aktivitou a inhibicí aktivity. Dále jsme prokázali, že peptidomimetické inhibitory SmCB1 jsou toxické pro krevničku. Získané výsledky otevírají cestu pro racionální vývoj inhibičních molekul jako potenciálních nových léčiv proti schistosomóze.
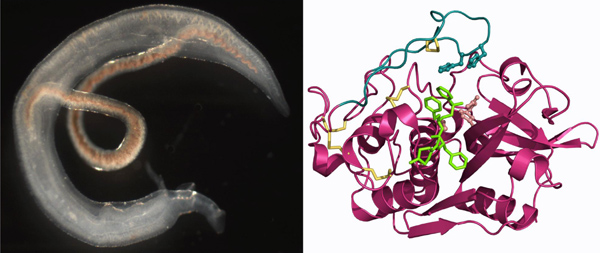
Vpravo: prostorová struktura enzymu SmCB1 interagujícího se syntetickým inhibitorem.
Jílková A., Řezáčova P., Lepšík M., Horn M., Váchová J., Fanfrlík J., Brynda J., McKerrow J.H., Caffrey C.R., Mareš M.:
Chemické chránění DNA před enzymatickým štěpenímByla vyvinuta dvoukroková velmi jednoduchá metodika přípravy chráněné DNA , která sestává ze syntézy chráněných nukleosid trifosfátů a jejich enzymatické inkorporace do DNA polymerasou. Pomocí PCR lze připravit DNA, ozdobenou objemnými chránícími skupinami ve velkém žlábku, o jakékoli délce a sekvenci. Takto chráněná DNA je resistentní vůči štěpení restrikčními endonukleasami, i když obsahuje sekvence specifické pro daný enzym. Reakcí s amoniakem jsou ale všechny objemné silylové skupiny odštěpeny a vzniklá DNA modifikovaná pouze malými ethynylovými skupinami už je rozpoznatelná enzymy a podléhá štěpení. Jedná se o první příklad přepínatelného chránění DNA před štepením a v obecné rovině i před specifickou vazbou proteinu. Přepínání štěpitelnosti by mohlo být užitečné v molekulární biologii pro manipulace dlouhých úseků DNA, kde se daná rozpoznávací sekvence může vyskytovat v několika kopiích.
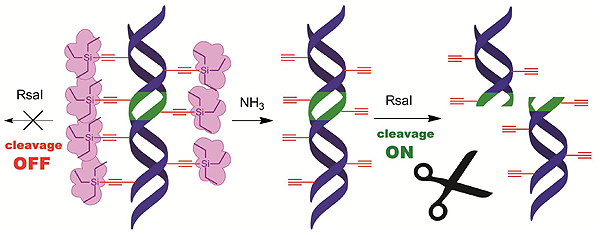 Pomocí PCR lze připravit DNA, ozdobenou objemnými chránícími skupinami ve velkém žlábku, o jakékoli délce a sekvenci. Takto chráněná DNA je resistentní vůči štěpení restrikčními endonukleasami, i když obsahuje sekvence specifické pro daný enzym. Reakcí s amoniakem jsou ale všechny objemné silylové skupiny odštěpeny a vzniklá DNA modifikovaná pouze malými ethynylovými skupinami už je rozpoznatelná enzymy a podléhá štěpení. Jedná se o první příklad přepínatelného chránění DNA před štepením a v obecné rovině i před specifickou vazbou proteinu.
Kielkowski P., Macíčková-Cahová H., Pohl R., Hocek M.: |