Homeostáze kationtů alkalických kovů a pH v buňkách
Koncentrace draselných a sodných iontů, jakož i koncentrace protonů (pH), je v buňkách přísně regulována na úrovni řady membránových proteinů, které přes buněčné membrány přenášejí kationty a protony pomocí různých transportních mechanismů. Nesprávné fungování některých transportérů může mít za následek vážné poruchy a onemocnění. Detailně proto zkoumáme úlohu jednotlivých transportérů a vliv jejich aktivity na zdraví buněk.
Draselné kationty jsou klíčové pro mnoho fyziologických procesů (např. pro kompenzaci negativního náboje makromolekul, regulaci vnitrobuněčného pH, membránového potenciálu nebo buněčného objemu). Naopak zvýšené hladiny ostatních kationtů alkalických kovů (Li+, Na+, Rb+) jsou pro buňky toxické. Pro udržení optimální koncentrace kationtů v cytosolu využívají buňky celou řadu transportních systémů, jejichž dokonalá souhra zajišťuje buňce stálé vnitřní prostředí nezbytné pro udržení života.
Kvasinka S. cerevisiae disponuje více než deseti různými transportéry pro kationty K+, Na+ a H+ lokalizovanými v plasmatické membráně (zajišťují vstup a výstup kationtů z buněk) nebo v membránách vnitrobuněčných organel (podílí se na transportu kationtů mezi cytosolem a buněčnými organelami). Charakterizací jednotlivých transportérů se snažíme pochopit, jak se eukaryotní buňky přizpůsobují neustálým změnám hladin iontů ve vnějším prostředí.

Transportní systémy pro K+ a Na+ v kvasince S. cerevisiae (červenou hvězdičkou jsou označeny transportní systémy, na jejichž charakterizaci jsme se podíleli).
U jednotlivých transportérů nás zajímá:
1. Lokalizace
Studované proteiny značíme fluorescenčními značkami a pozorujeme buňky syntetizující tyto proteiny ve fluorescenčním mikroskopu.
 |
 |
 |
||||
| Nha1-GFP v plasmatické membráně (Kinclová et al., 2001) |
Vhc1-GFP ve vakuolární membráně (Petrezselyová et al., 2013) |
Kha1-GFP v Golgiho aparátu (Marešová et al., 2006) |
Příklady lokalizace transportérů v kvasince S. cerevisiae
2. Struktura
Pomocí mutageneze hledáme aminokyselinové zbytky důležité pro fungování transportéru.

Strukturní (3D) model transmembránové oblasti Na+/H+ antiportního systému Sod2-22 z kvasinky Z. rouxii vytvořený na základě podobnosti s antiporterem NhaA z bakterie Escherichia coli (Kinclova-Zimmermannova et al., 2015). (a) Celkový pohled z boku. Vyznačeny jsou aminokyselinové zbytky Thr141, Ala179, Phe180 and Val375 důležité pro substrátovou specifitu transportéru (b) Detailní pohled na hydrofobní filtr důležitý pro určení substrátové specifity antiporterů Na+/H+ kvasinek. Pohled na TMS 2, 4, 5 a 11 v modelu 3D shora. Pravděpodobné vazebné místo pro kationty (Asp176) je umístěno za hydrofobním filtrem.
Charakterizace rodiny antiporterů Nha/Sod lokalizovaných v plasmatické membráně kvasinek.
Do rodiny antiporterů Na+/H+ plasmatické membrány kvasinek patří přenašeče, které transportují všechny kationty alkalických kovů (Li+, Na+, K+, Rb+), ale také systémy, jež rozpoznávají pouze Li+ a Na+ (Kinclová et al, 2002). Identifikovali jsme aminokyselinové zbytky ve 4. (Thr141, Pro145 a Ser150), v 5. (Ala179) a v 11. (Val375) transmembránové doméně (TMS) důležité pro rozpoznání, vazbu a transport kationtů. Mutace těchto zbytků vedly ke změně/rozšíření substrátové specifity pro kationty K+ u antiporteru Sod2-22 z kvasinky Zygosaccharomyces rouxii (Kinclova-Zimmermannova et al., 2005; 2006; 2015). Vytvořili jsme 3D-model transmembránové oblasti proteinu Sod2-22 a zjistili jsme, že aminokyseliny idetifikované pomocí mutageneze tvoří v centrální části proteinu hydrofobní filtr důležitý pro určení substrátové specifity antiporterů Na+/H+ (Kinclová-Zimmermannová et al., 2015). V současné době hledáme další oblasti proteinu určující substrátovou specifitu a transportní aktivitu v antiporterech Nha/Sod kvasinek.
3. Transportní vlastnosti
Určujeme substrátovou specifitu a transportní aktivitu transportérů.

Fylogenetický strom ukazuje příbuznost kvasinkových Na+/H+ antiporterů plasmatické membrány, na jejichž charakterizaci se podílela naše laboratoř. Modře jsou označeny antiportery rozpoznávající jako substrát výhradně nebo s výrazně vyšší afinitou kationty Na+ a Li+ a sloužící tak kvasinkám především pro odstraňování toxických kationtů z buněk. Červeně označené proteiny exportují z buněk také draselné kationty a jejich úloha ve fyziologii buněk je komplexnější – podílí se na regulaci buněčného obsahu K+, vnitrobuněčného pH a objemu buněk.
4. Regulace aktivity
Na úrovni exprese genu, biogeneze daného proteinu či interakce s jinými proteiny.
Geny pro jednotlivé transportéry mohou být v buňkách S. cerevisiae deletovány. Naše laboratoř vlastní obsáhlou sbírku kmenů s delecemi jednotlivých transportních systémů nebo s kombinacemi delecí. V současné době hledáme nové regulační mechanismy, které se podílejí na udržování hemeostáze kationtů a pH v eukaryotních buňkách, např. na úrovni biogeneze transportérů (Rosas-Santiago et al., 2015, 2016), pomocí vzájemného propojení mezi transportéry protonů, draselných a/nebo vápenatých kationtů (Zimmermannova at al., 2015; Papouskova et al., 2015) nebo protřednictvím složení buněčných membrán (Kodedová at al., 2015). Kmeny kvasinek postrádající vlastní transportní systémy využíváme také ke studiu transportních systémů z jiných organismů (rostlin, živočichůi člověka).
Zachování stálých koncentrací všech iontů je zásadní také pro rostlinné a živočišné buňky. Na udržování nízké hladiny Na+ v cytosolu rostlinných buněk se podílí zejména Na+/H+ antiportery v plasmatické membráně a v membránách vakuoly. Naše mutantní kmeny kvasinek postrádající transportéry pro kationty alkalických kovů byly použity pro charakterizaci transportních vlastností rostlinného transportéru OsNhx1 z rýže (Oryza sativa; Kinclová et al., 2004). Bylo zjištěno, že se jedná o antiporter se širokou substrátovou specifitou pro kationty Li+, Na+, K+ a Rb+. Charakterizace transportéru AtChx17 z huseníčku rolního (Arabidopsis thaliana) v kvasinkách zase ukázala, že se pravděpodobně jedná o antiporter K+/H+ lokalizovaný v Golgiho aparátu, jenž se podílí na regulaci vnitrobuněčného obsahu kationtů K+ a protonů (Marešová et al., 2006). V obou případech rostlinné transportéry byly schopné funkčně nahradit homologní proteiny z kvasinek.
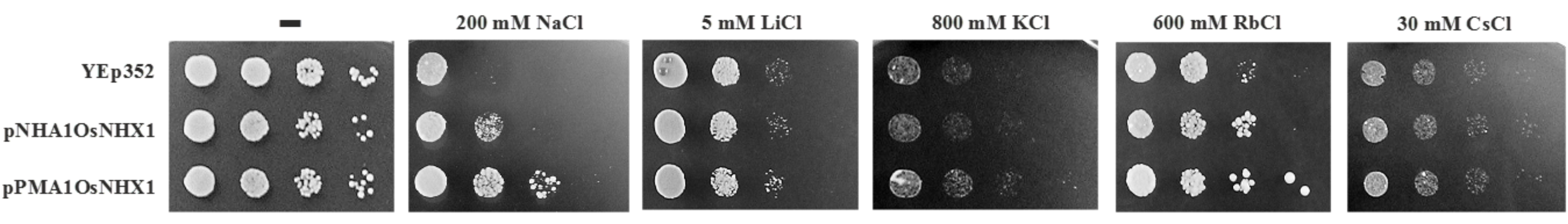
Exprese antiporteru OsNhx1 z rýže zlepšuje růst buněk kvasinek v přítomnosti vysoké koncentrace kationtů Na+, Li+, K+, Rb+, ale ne Cs+. Antiporter byl exprimován v kmeni S. cerevisiae AW22 postrádajícím geny pro antiportery Nha1 a Nhx1 a sodné ATPasy Ena pod kontrolou buď slabého promotoru (pNHA1OsNHX1) nebo silného promotoru (pPMA1OsNHX1).
Studium lidského proteinu NHA2. Lidský Antiporter NHA2 je specificky exprimován v kostních buňkách, kde je nezbytný pro buněčnou diferenciaci. Jeho nedostatečná aktivita vede k závažným vývojovým onemocněním. Díky jeho heterologní expresi v kmeni kvasinky S. cerevisiae postrádajícím vlastní exportéry Na+ jsme ve spolupráci s vědci z USA a Číny identifikovali některé aminokyselinové zbytky významné pro transportní aktivitu proteinu (Huang et al., 2010).
Charakterizace savčích draselných kanálů. Kvasinka S. cerevisiae se také ukázala být vhodným modelem pro expresi a charakterizaci savčích draselných kanálů, např. Kir2.1 (Koláčná et al., 2005), jehož mutace je u člověka spojena s Andersenovým syndromem postihujícím srdeční činnost, nebo EAG1 (Schwarzer et al., 2008), který je vysoce exprimován v mozku a jehož nadprodukce může přispívat k nádorovému růstu.
© 2014 Fyziologický ústav AV ČR