Studium regulačních proteinů účastnících se G-proteinové signalizace: RGS3 a fosducinu.
Regulátor G-proteinové signalizace (RGS3) se váže na Gα-GTP komplex a zvyšuje tak jeho vnitřní GTPasovou aktivitu - ukončuje přenos signálu. Fosducin (Pdc) je vysoce konzervovaný fosfoprotein, který hraje důležitou roli v regulaci G-proteinové signalizace, kontroly transkripce a regulaci krevního tlaku. Pdc i RGS3 jsou negativně regulovány fosforylací a vazbou proteinu 14-3-3.
Biofyzikální studie
Naše data naznačují, že fosforylace na N-koncové doméně fosducinu (na serinu 54 a serinu 73) ovlivňují strukturu celé molekuly fosducinu. Komplex tvořený s proteinem 14-3-3 snižuje flexibilitu jak na v obou koncových částech fosforylovaného fosducinu (N- i C-konec), což jsme potvrdili časově-rozlišenou tryptofanovou a dansylovou fluorescencí. Naše data naznačují, že fosforylovaný fosducin podstoupí konformační změnu po vazbě na protein 14-3-3. Tyto změny zahrnují vazebný povrch Gtbg v rámci N-koncové domény fosducinu a tak by mohly vysvětlit inhibiční efekt proteinu 14-3-3 na funkci fosducinu.
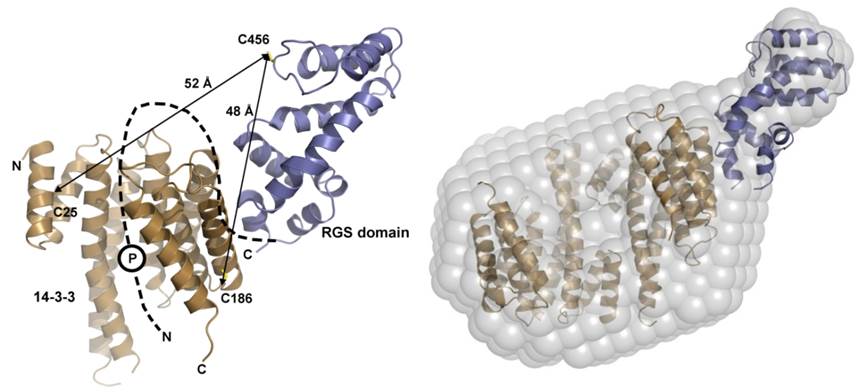
V roce 2011 jsme použili nízkoúhlový rozptyl světla, vodíko-deuteriovou výměnu a Försterův resonanční přenos energie k určení struktury komplexu protein 14-3-3ζ s RGS3 (Rezabkova et al., 2011).
 |
|
|
Stužková reprezentace struktury komplexu RGS domény a proteinu 14-3-3 se vzdálenostmi určenými pomocí FRET měření (Rezabkova et. al., 2010) Struktura komplexu 14-3-3:pRGS3 s nízkým rozlišením obdržená z měření SAXS (Rezabkova et al., 2011). |

Protein 14-3-3ζ interaguje a stéricky blokuje N- i C-koncovou část Gtβγ vazebného povrchu fosducinu (Kacirova et al. 2015)
© 2014 Fyziologický ústav AV ČR