Výzkum iontového kanálu TRPA1 může pomoci při objasnění příčin chronické bolesti (3.2. 2020)
Řada závažných onemocnění je doprovázena chronickou bolestí, jejíž molekulární mechanismy nejsou prozatím plně objasněny. Výzkumem iontového kanálu TRPA1, který se uplatňuje v těchto mechanismech, se zabývají vědci z oddělení Buněčné neurofyziologie Fyziologického ústavu AV ČR. Ve spolupráci s laboratoří CBMN Univerzity v Bordeaux prokázali, že aktivita lidského TRPA1 je významně regulována membránovými fosfolipidy na záporných membránových potenciálech. Podařilo se identifikovat vazebné místo TRPA1 kanálu, které interaguje s fosfolipidy při nízkých koncentracích vápenatých iontů. Stejné místo může při vyšších koncentracích vázat regulační protein kalmodulin a modulovat tak iontový kanál způsobem závislým na jeho aktivitě. Tyto nové nálezy naznačují, že pro aktivaci TRPA1 je za fyziologických podmínek důležité správné složení plazmatické membrány zajišťující v oblasti rozhraní mezi podjednotkami převod signálů na otevírání iontového kanálu.

(A) Elektrofyziologické záznamy TRPA1 odpovědí na karvakrol (100 µM) a zvýšenou koncentraci vápenatých iontů (z 0 na 0.5 mM). Záznamy ze dvou F11 buněk snímané pipetou naplněnou (vlevo) kontrolním roztokem a (vpravo) roztokem s přidaným specifickým peptidem T1003-P1034. Dole, navržený mechanizmus, kterým o vazebné místo TRPA1 soutěží kalmodulin (CaM) a fosfolipid (PIP2). (B) Vazebné místo pro fosfolipidy v oblasti rozhraní dvou sousedních podjednotek TRPA1 kanálu. Zobrazena je jen transmembránová část podílející se na vazbě a převodu signalizace do vrátek (gate) kanálu (PDB kód struktury 6pqq). Úloha fenylalaninu Phe1020 v interakci byla prokázána v uvedené studii.
MACIKOVA L, SINICA V, KADKOVA A, VILLETTE S, CIACCAFAVA A, FAHERTY J, LECOMTE S, ALVES ID, VLACHOVA V: Putative interaction site for membrane phospholipids controls activation of TRPA1 channel at physiological membrane potentials. The FEBS Journal 286: 3664-3683, 2019.
Inovativní metoda regulace Forkhead transkripčního faktoru FOXO3 (29.1. 2020)
Studie otištěná v prestižním časopise eLife identifikuje nízkomolekulární sloučeniny, které interagují s transkripčním faktorem Forkhead box O3 (FOXO3) a modulují tak jeho aktivitu.
Protein FOXO3 s charakteristickou DNA-vazebnou doménou je součástí podtřídy O rodiny Forkhead transkripčních faktorů. Tyto transkripční faktory jsou v savčích buňkách klíčovými regulátory buněčné homeostázy, diferenciace, délky života a řízené buněčné smrti. Aktivita FOXO3 také významně přispívá k rezistenci rakovinných buněk vůči chemo- a radioterapii. Nejnovější studie rovněž ukázaly, že se DNA-vazebná doména (DBD) FOXO proteinů účastní protein-proteinových interakcí s dalšími klíčovými regulátory délky života, buněčné smrti a lékové rezistence. Reverzibilní inhibice aktivity FOXO3 prostřednictvím nízkomolekulárních sloučenin by tak mohla podpořit protinádorové imunitní odpovědi.
K inhibici aktivity FOXO3 bylo nejdříve nezbytné identifikovat nízkomolekulární sloučeniny, které by blokovaly interakci mezi FOXO3 DBD a DNA. Na základě struktury FOXO3 DBD a FOXO4 DBD bylo vytvořeno šest různých farmakoforových modelů, které byly využity pro in silico screening databází nízkomolekulárních sloučenin. U vybraných sloučenin byla následně testována schopnost inhibovat funkci FOXO3 jak in vitro, tak i v nádorových buněčných kulturách. Interakce sloučenin s FOXO3 DBD byly charakterizovány pomocí metod NMR spektroskopie a molekulového dokování.
Týmy dr. Veroniky Obšilové z Fyziologického ústavu AV ČR z BIOCEV a prof. Tomáše Obšila z Přírodovědecké fakulty UK ve spolupráci se skupinou prof. M. J. Ausserlechnera z Medical University Innsbruck, Rakousko identifikovaly sloučeniny S9 a její oxalátovou sůl S9OX jako látky schopné inhibovat FOXO3 v nádorových buňkách. Vědci zároveň vyslovili domněnku, že díky svému způsobu vazby na FOXO3 DBD mohou také S9 sloučeniny bránit protein-proteinovým interakcím mezi FOXO3 a jeho vazebnými partnery. Výhodou těchto látek je, že nejsou imunogenní, což umožňuje nastavení dávky a délky aplikace tak, aby byla posílena protinádorová imunita a zároveň byly omezeny nežádoucí efekty inhibice FOXO proteinů u kmenových buněk a somatických tkání. Další výzkum bude zaměřen na zjištění, jestli lze S9 využít jako základ pro vývoj sloučenin schopných specificky modulovat funkce jednotlivých FOXO transkripčních faktorů.

Sloučeniny S9 blokují DNA-vazebný povrch Forkhead transkripčního faktoru FOXO3. Na obrázku je znázorněn strukturní model DNA-vazebné domény FOXO3 s navázanou sloučeninou S9 založený na datech z měření jaderné magnetické resonance a molekulového dokování.
Hagenbuchner, J.+, Obšilová, V.+, Kaserer, T.+, Kaiser, N., Rass, B., Pšenáková, K., Dočekal, V., Alblová, M., Kohoutová, K., Schuster, D., Aneichyk, T., Veselý, J., Obexer, P., Obšil, T.*, Ausserlechner, M. J.* Modulování transkripční aktivity FOXO3 malými DBD-vazebnými molekulami. eLife. 2019, 8(Dec 4), e48876. doi: 10.7554/eLife.48876
Transkripční faktor Hif-1a je nezbytný pro správný vývoj sympatického nervového systému a inervaci srdce (16.1. 2020)
Hypoxií indukovaný faktor 1 (Hif-1) je hlavním regulátorem transkripční odpovědi buněk na sníženou dostupnost kyslíku. Výzkum probíhající v laboratořích Biotechnologického a Fyziologického ústavu AV ČR a 1. Lékařské fakulty UK ukázal, že genetická mutace genu Hif-1a potlačuje embryonální vývoj pregangliových a postgangliových neuronů sympatického nervového systému a negativně ovlivňuje sympatickou inervaci srdce, která hraje primární úlohu při regulaci tepové frekvence a srdeční kontraktility při zátěži. U myši s podmíněnou delecí genu Hif-1a byl zjištěn anomální vývoj architektury koronárního řečiště a snížená kontraktilní funkce srdce. Tyto nové nálezy ukazují, že dysfunkce tohoto transkripčního faktoru může vést k rozvoji závažných kardiovaskulárních onemocnění spojených s poruchou rovnováhy autonomního nervového systému a zároveň otevírají nové možnosti léčby těchto onemocnění v budoucí klinické praxi.

Zhoršený vývoj sympatické inervace srdce s delecí Hif-1a (Hif1aCKO): Immunohistochemická detekce nervových vláken pomocí tyrozin hydroxylázy (TH) a kvantifikace TH-pozitivních vláken u kontrolních and Hif1aCKO srdcí v embryonálním stádiu E16.5.
Bohuslavová, Romana - Čerychová, Radka - Papoušek, František - Olejníčková, Veronika - Bartoš, M. - Goerlach, A. - Kolář, František - Sedmera, David - Semenza, G.L. - Pavlínková, Gabriela: HIF-1 alpha is required for development of the sympathetic nervous system. Proceedings of the National Academy of Sciences of the United States of America. Roč. 116, č. 27 (2019), s. 13414-13423. ISSN 0027-8424, IF: 9.580, 2018.
Odolnost beta buněk slinivky břišní proti oxidativnímu stresu, který doprovází cukrovku 2. typu, zvyšují antioxidační látky působící v mitochondriích (15.1. 2020)
Zvýšená hladina cukru v krvi způsobuje sekreci hormonu inzulínu z β-buněk Langerhansových ostrůvků v slinivce břišní. Tato odpověď je řízena tzv. redoxní signalizací, přičemž mírně zvýšená hladina reaktivních kyslíkových sloučenin (ROS), např. H2O2, spustí regulaci proteinových kaskád, která vyústí v sekreci inzulinu z inzulinových granulí v b-buňkách. Nadměrná produkce ROS však způsobuje patologický oxidativní stres, který provází řadu nemocí, včetně cukrovky 2. typu. Oxidativní stres lze snížit posílením antioxidační obrany buněk. Mitochondrie jsou důležité energetické továrny všech buněk a taktéž jeden z hlavních zdrojů produkce ROS. V naší práci jsme testovali účinek třech nových antioxidačních molekul (SkQ, S3QEL a S1QEL) působících v mitochondriích b-buněk na místech produkce ROS. Odhalili jsme podrobně mechanismus působení těchto látek, které na různých místech v mitochondriích specificky zabraňují tvorbě ROS a mohou mít roli antioxidační, ale i pro-oxidační v závislosti na energetickém metabolismu buňky a na dostupnosti energetického substrátu (např. přítomnosti glukózy). Například antioxidant SkQ působí v b-buňkách jako antioxidant především při nadbytku energetického substrátu, což znamená in vivo po jídle. Naopak, při hladovění, se SkQ chová krátkodobě jako pro-oxidační molekula a zvyšuje již přítomný oxidační stres. Detailní znalost mechanismu působení těchto antioxidačních molekul v β-buňkách slinivky může pomoci v léčbě cukrovky.
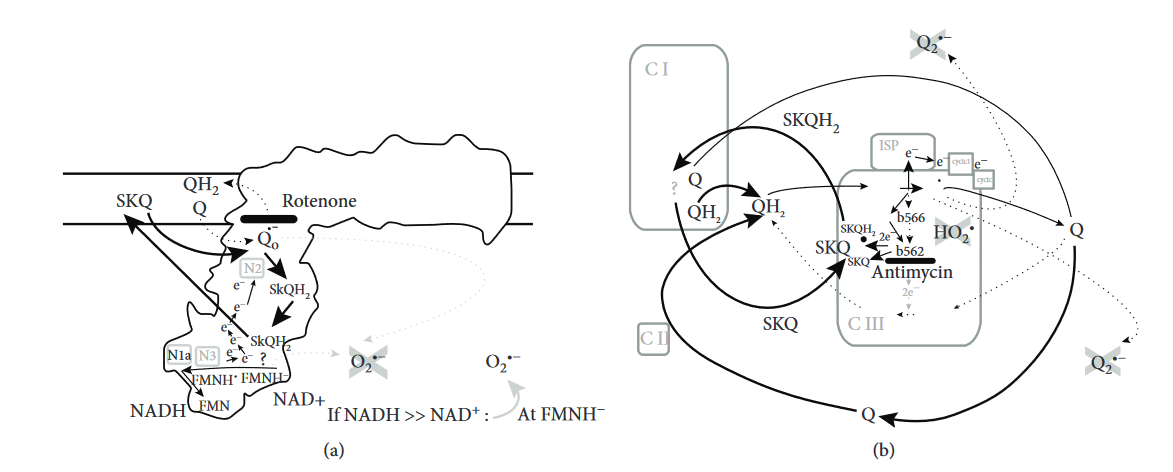
Obrázek možného účinku SkQ: Navržený mechanismus antioxidační aktivity mitochondriálně cíleného SkQ: (a) antioxidační dvouelektronová redukce SkQ na SkQH2 a jeho regenerace (oxidace SkQH2) na elektron transportním komplexu I mitochondrií, na základě reference [1]; (b) antioxidační dvou elektronová redukce SkQ na SkQH2 na elektron transportním komplexu III mitochondrií a regenerace na komplexu I, na základě reference [1]
Plecitá-Hlavatá; Lydie - Engstová; Hana - Ježek; Jan - Holendová; Blanka - Tauber; Jan - Petrásková; Lucie - Křen; Vladimír - Ježek; Petr . Potential of Mitochondria-Targeted Antioxidants to Prevent Oxidative Stress in Pancreatic beta-cells . Oxidative Medicine and Cellular Longevity. 2019; 2019(2019)); 1826303 . IF = 4.868.
Nadějný farmakologický přístup pro léčbu kardiovaskulárních onemocnění (9.7. 2019)
Epoxyeikosatrienové kyseliny (EETs), metabolity kyseliny arachidonové syntetizované enzymem cytochrom P450 epoxygenázou, představují nadějný farmakologický přístup v léčbě řady kardiovaskulárních onemocnění. V naší studii jsme analyzovali vliv EET-B, nového orálně aktivního analogu 14,15-EET, na rozvoj srdečního selhání po infarktu myokardu u spontánně hypertenzních potkanů (SHR), preklinického modelu esenciální hypertenze. SHR byli jak před, tak po infarktu myokardu léčeni EET-B. Na konci experimentu byla analyzována funkce levé komory, míra srdeční fibrózy a zánětu. Vzhledem k tomu, že EETs mohou snižovat rozvoj srdečního selhání aktivací enzymu hem oxygenázy-1, stanovili jsme jeho expresi ve viabilních myocytech srdce vystaveného infarktu. Zjistili jsme, že chronické podávání EET-B významně zpomalilo rozvoj postischemické dysfunkce levé komory, zvýšilo imunopozitivitu hem oxygenázy-1 v kardiomyocytech ovlivněných infarktem a snížilo míru fibrózy a zánětu. Tyto výsledky ukazují, že EETs analog EET-B má terapeutický potenciál pozitivně ovlivnit nežádoucí remodelaci srdce u SHR potkanů po infarktu myokardu.
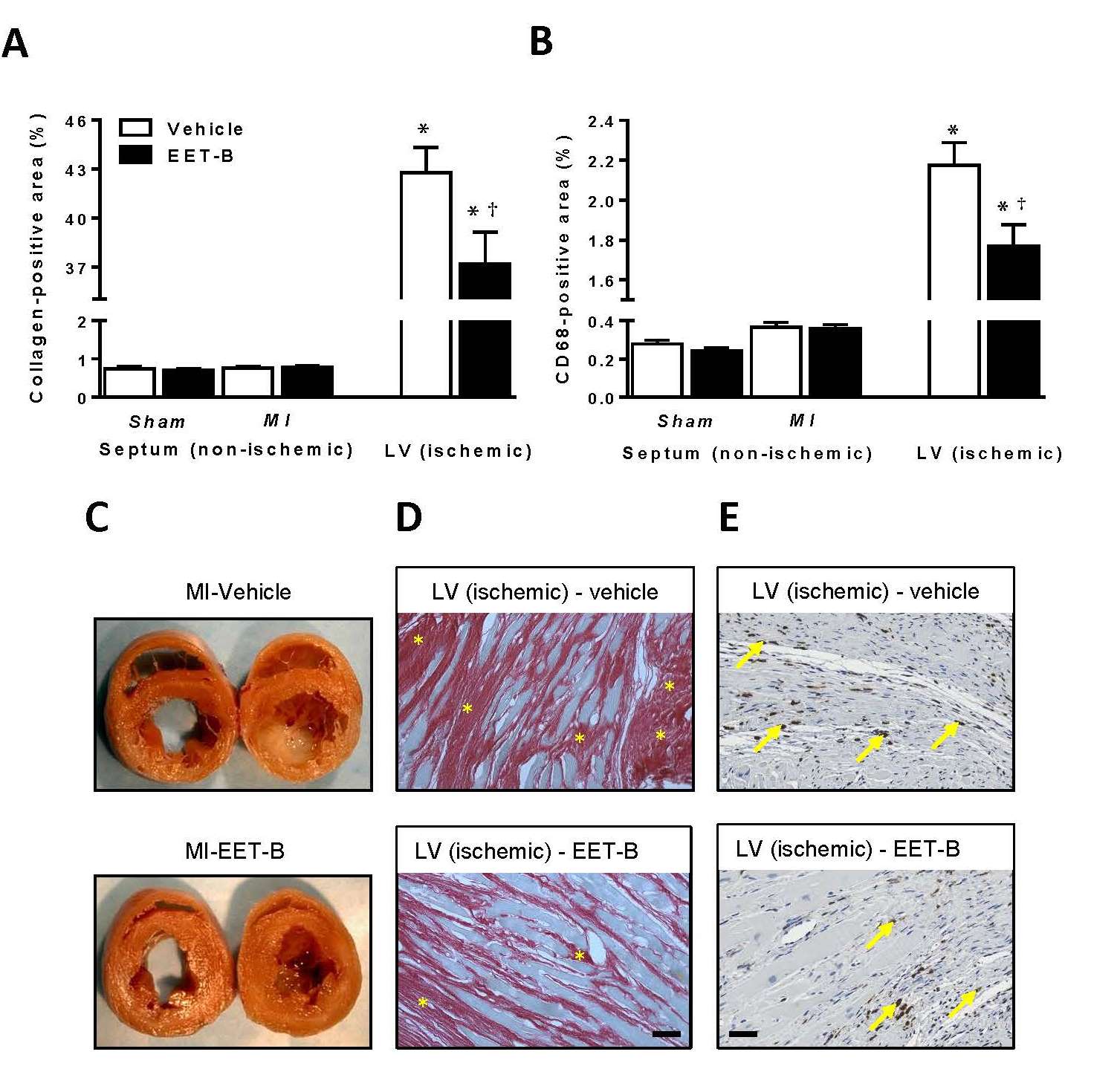
8.Neckář, Jan - Khan, M. A. H. - Gross, G. J. - Cyprová, Michaela - Hrdlička, Jaroslav - Kvasilová, A. - Falck, J. R. - Campbell, W. B. - Sedláková, Lenka - Škutová, Šárka - Olejníčková, Veronika - Gregorovičová, Martina - Sedmera, David - Kolář, František - Imig, J. D. Epoxyeicosatrienoic acid analog EET-B attenuates post-myocardial infarction remodeling in spontaneously hypertensive rats. Clinical science. Roč. 133, č. 8 (2019), s. 939-951. ISSN 0143-5221, IF: 5,237 (2018).
Načíst další




