Neurosteroid pregnenolon sulfát - odhalení místa jeho působení na N-methyl-D-aspartátový receptor (26.10. 2020)
NMDA receptory jsou iontové kanály podílející se na přenosu elektrického signálu mezi nervovými buňkami. Jejich snížená funkce přispívá k řadě závažných neuropsychiatrických onemocnění, jako například ke schizofrenii, či autismu. Aktivita NMDA receptorů může být zvýšena prostřednictvím nejrůznějších látek včetně neurosteroidů. Ve spolupráci s Ústavem organické chemie a biochemie AV ČRse nám podařilo odhalit vazebné místo a objasnit mechanismus působení pro přirozeně se vyskytující neurosteroid pregnenolon sulfát (PES). PES se váže na rozhraní membránových domén NMDA receptoru v zavřeném stavu, což po následné aktivaci receptoru pomocí glutamátu vede k přeuspořádání membránových domén a stabilizaci otevřeného stavu iontového kanálu NMDA receptoru. Dané poznatky mohou přispět k vývoji nových látek pro léčbu onemocnění spojených s nedostatečnou funkcí glutamátergního systému.

Interakce molekuly PES (zeleně) s membránovými doménami NMDA receptoru v otevřeném stavu získaná dokováním následovaným molekulárně-dynamickou simulací. Aminokyseliny zapojené do interakce s molekulou PES jsou vyznačeny červeně.
Hrčka Krausová B, Kysilov B, Černý J, Vyklický V, Smejkalová T, Ladislav M, Balík A, Kořínek M, Chodounská H, Kudová E, Vyklický ml. L. Site of Action of Brain Neurosteroid Pregnenolone Sulfate at the N-Methyl-D-Aspartate Receptor. Journal of Neuroscience. 2020; 40 (31) 5922-5936. IF: 5.673
Dietní suplementace olejem z Krilu jako nová strategie ke zlepšení citlivosti organismu k inzulínu a snížení akumulace tuku v játrech při obezitě (20.10. 2020)
Změna životního stylu zahrnující i zdravou výživu představuje důležitou součást strategie prevence i léčby negativních metabolických důsledků obezity. Olej z Krilu jako extrakt z antarktického krilu Euphausia superba (tj. korýšů vyskytujících se v antarktických vodách) je relativně novým zdrojem omega-3 polynenasycených mastných kyselin (Omega-3). Bylo prokázáno, že doplňky stravy obsahující Omega-3, obvykle podávané ve formě koncentrátu na bázi triacylglycerolů nebo ethylesterů, mohou snížit zánět a nadměrné ukládání tuku v játrech (tj. jaterní steatózu).
U obézních pacientů s diabetem 2. typu však podávání těchto forem Omega-3 nemusí nutně vést ke zlepšení citlivosti organismu k inzulínu, a navíc může zhoršit dlouhodobou kontrolu metabolismu glukózy. Proto jsme na obézních myších testovali, zda podání Omega-3 navázaných na jiný lipidový nosič, v tomto případě na fosfolipidy v krilovém oleji, může mít příznivé metabolické účinky a zároveň zlepšit metabolismus glukózy a citlivost organismu k inzulínu.
Naše studie prokázaly, že suplementace krillovým olejem dokáže snížit steatózu jater více než Omega-3 podávané ve formě triacylglycerolů, a tento účinek krillového oleje byl doprovázen zlepšenou inzulínovou citlivostí na úrovni jater i celého těla. Příznivý účinek krilového oleje na glukózovou homeostázu byl spojen nejen se zlepšenou biologickou dostupností Omega-3 (např. EPA, n-3 DPA) ve tkáních, ale také s cirkulujícími hladinami kyseliny palmitolejové, již dříve identifikovaného lipokinu (tj. hormonu lipidové povahy) s inzulín-senzitizujícími vlastnostmi, jehož obsah je v krilovém oleji zvýšen. Kromě toho olej z krilu účinněji než Omega-3 na bázi triacylglycerolů indukoval katabolismus mastných kyselin v tenkém střevě. Tento proces by tak mohl přispívat k silnému antisteatotickému účinku krilového oleje. Naše výsledky poskytují obecné zdůvodnění pro použití fosfolipidů s obsahem Omega-3 jako doplňků výživy se silnými inzulín-senzitizujícími a antisteatotickými účinky.

Samci C57BL/6N myší byli krmeni po dobu 8 týdnů dietou s vysokým obsahem tuku na bázi kukuřičného oleje (cHF) nebo doplněnou koncentrátem Omega-3 obsažených v triacylglycerolech (cHF+ω3TG) nebo fosfolipidech z krilového oleje (cHF+ω3PL); štíhlé kontroly byly krmeny nízkotučnou standardní dietou (A). Podávání cHF zhoršilo citlivost k inzulínu (stanoveno měřením rychlosti infůze glukózy během hyperinzulinemické-euglykemické svorky; B – nahoře) a způsobilo výraznou akumulaci lipidů v játrech (tj. steatózu jater; B – dole). Zatímco u cHF+ω3PL myší byla citlivost k inzulínu téměř zachována a jaterní steatóza prakticky eliminována, u cHF+ω3TG myší byly pozorovány mnohem méně výrazné účinky. Příznivé metabolické změny pozorované po podání krillového oleje mohou souviset se zvýšenými hladinami inzulín-senzitizujícího lipokinu palmitoleátu (POA) v cirkulaci (C – nahoře) a zvýšeným katabolismem mastných kyselin přímo ve střevní tkáni (C – dole).
Rossmeisl M, Pavlisova J, Bardova K, Kalendova V, Buresova J, Kuda O, Kroupova P, Stankova B, Tvrzicka E, Fiserova E, Horakova O, Kopecky J. Increased plasma levels of palmitoleic acid may contribute to beneficial effects of Krill oil on glucose homeostasis in dietary obese mice. Biochim Biophys Acta Mol Cell Biol Lipids. 2020;1865(8):158732. IF: 4.519
Kroupova P, van Schothorst EM, Keijer J, Bunschoten A, Vodicka M, Irodenko I, Oseeva M, Zacek P, Kopecky J, Rossmeisl M, Horakova O. Omega-3 Phospholipids from Krill Oil Enhance Intestinal Fatty Acid Oxidation More Effectively than Omega-3 Triacylglycerols in High-Fat Diet-Fed Obese Mice. Nutrients. 2020;12(7):2037. IF: 4.546
Nový mechanismus výlevu inzulinu poukazuje na důležitost redoxní signalizace (14.10. 2020)
Výlev inzulinu β buňkami pankreatických ostrůvků je esenciální pro udržení glukozové homeostázy v těle. Jeho porucha je příčinou cukrovky. Mechanismus výlevu byl donedávna úzce spjat výhradně se zvýšenou koncentrací energetické molekuly ATP v buňce, která iniciuje kaskádu výlevu inzulinu. Naše výsledky ukázaly, že kromě ATP je pro efektivní inzulinový výlev důležitá redoxní signalizace uvnitř β buňky. Konkrétně jsme poukázali na enzym NADPH oxidázu, izoformu 4, jejíž aktivita se zvýší po stimulaci β buňky glukózou. To vede ke krátkodobému zvýšení pro-oxidační molekuly, peroxidu vodíku, který spolu s ATP navodí výlev inzulinu. Výsledky poukazují na důležitou roli redoxní signalizace ve fyziologii β buňky.
Plecitá-Hlavatá L, Jabůrek M, Holendová B, Tauber J, Pavluch V, Berková Z, Cahová M, Schröder K, Brandes R.P, Siemen D, Ježek P Glucose-Stimulated Insulin Secretion Fundamentally Requires H(2)O(2)Signaling by NADPH Oxidase 4 . Diabetes. 2020; 69(7); 1341-1354,IF: 7.720
Detailní charakterizace redoxního prostředí β buňky přispěje k pochopení mechanismu výlevu inzulinu
Důležitost redoxní signalizace při výlevu inzulinu, jakožto reakce na zvýšenou hladinu glukózy v těle jsme popsali v publikaci výše. Důležitý enzym v tomto mechanismu je cytosolická NADPH oxidáza. Je ale známo, že mitochondrie kromě energetické molekuly ATP taktéž produkují superoxid a jiné kyslíkové reaktivní radikály, které by potenciálně mohly ovlivnit celkový redoxní stav β buňky a tím ovlivnit výlev inzulinu. V této práci jsme zjistili, že indukce glukózou naopak způsobí pokles produkce superoxidu v mitochondriích a popsali jsme molekulární mechanismus, jak k tomu dochází. K výzkumu jsme mimo jiné využili nové sondy a metodu fluorescenční mikroskopie umožňující sledování změn redoxního stavu v reálném čase v jednotlivých kompartmentech buňky.
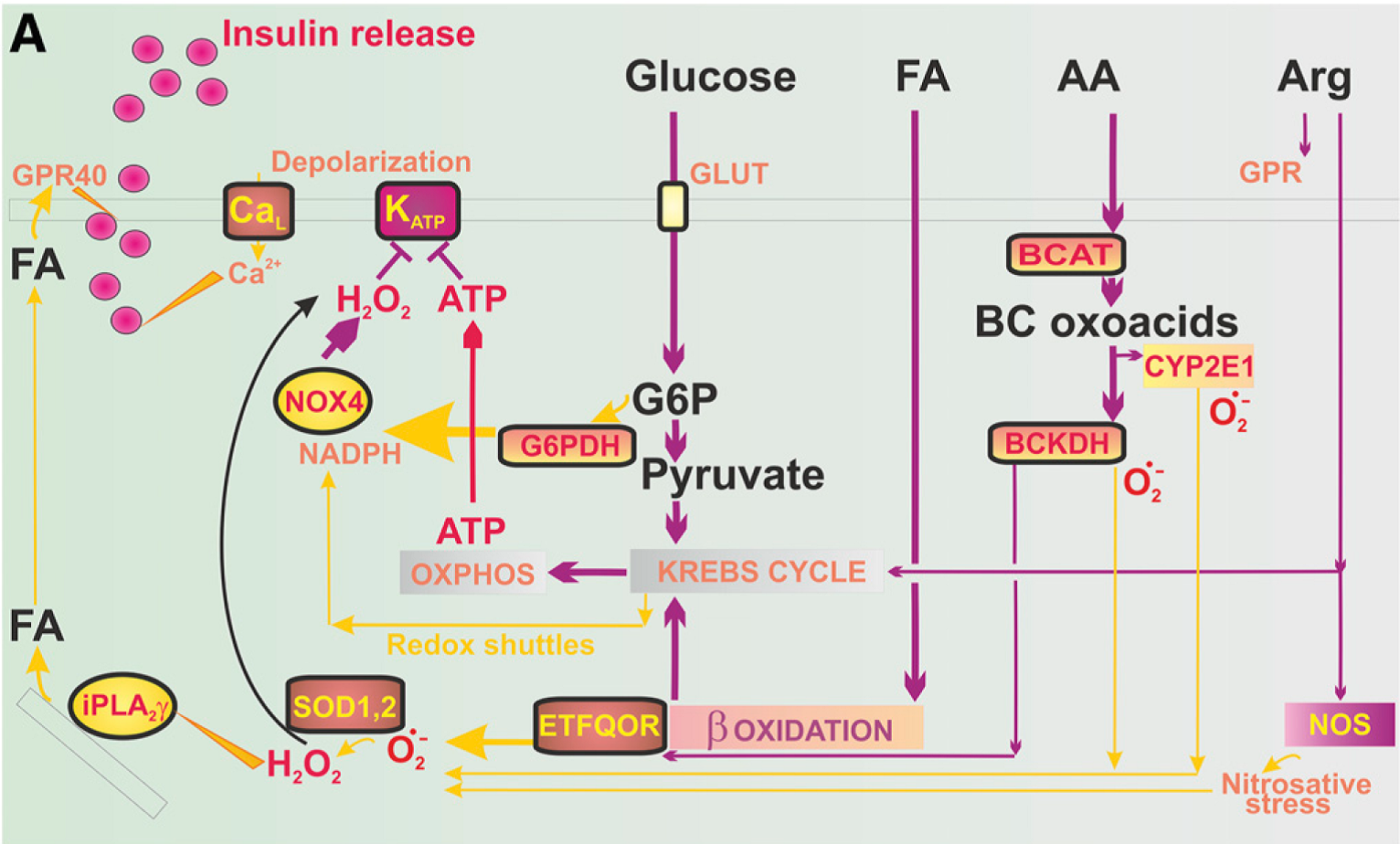

(A) Nový molekulární mechanismus výlevu inzulinu vyzdvihující roli redoxní signalizace u β buněk, kterou lze indukovat různými substráty (glukóza, mastné kyseliny (FA), aminokyselin (AA), Arginin (Arg)).
(B, C) Popis hlavních metabolických a redoxních toků v β buňce při klidové hladině glukózy (B, nezpůsobující výlev inzulinu) a vyšší hladině glukózy indukující výlev inzulinu (C).
Plecitá-Hlavatá L, Engstová H, Holendová B, Tauber J, Špaček T, Petrásková L, Křen V, Špačková J, Gotvaldová K,Ježek J, Dlasková A, Smolková K, Ježek P Mitochondrial Superoxide Production Decreases on Glucose-Stimulated Insulin Secretion in Pancreatic beta Cells Due to Decreasing Mitochondrial Matrix NADH/NAD(+) Ratio . Antioxidants & Redox Signaling. 2020; 33(12); 789-815 . IF: 6.323
Losartan snižuje neuropatickou bolest a zánět u modelu periferní neuropatie vyvolané podáváním cytostatika Paclitaxel (13.10. 2020)
Léčba onkologických pacientů paclitaxelem často vede k rozvoji periferní neuropatie, neuropatické bolesti a zánětlivým změnám v periferní a centrální nervové soustavě. Dostupná analgetická léčba bolesti u těchto stavů má výrazné nežádoucí účinky a je velmi málo účinná. Je proto potřeba pochopit mechanismy vzniku těchto neuropatických stavů, abychom mohli vyvinout nové léky, které by bolest tlumily lépe. Bylo ukázáno, že běžně používaný lék na léčbu vysokého krevního tlaku losartan, může mít u modelů jiných onemocnění protizánětlivé a neuroprotektivní účinky. V naší práci jsme ukázali, že systémové podání losartanu výrazně oslabilo mechanickou allodynii (bolest na slabé mechanické podněty) u potkanů, u nichž byla navozena neuropatická bolest podáváním paclitaxelu. Losartan současně také významně snížil paclitaxelem navozené zánětlivé změny a navodil expresi protizánětlivých markerů, naznačující možný posun v polarizaci makrofágů. Vzhledem k dobrému profilu nežádoucích účinků losartanu by bylo možné zvážit jeho podávání jako možný nový nástroj na omezení vzniku neuropatické bolesti u pacientů léčených paclitaxelem.

Kalynovska N, Diallo M, Sotáková-Kašparová D, Paleček J Losartan attenuates neuroinflammation and neuropathic pain in paclitaxel-induced peripheral neuropathy. Journal of Cellular and Molecular Medicine 24, 14 (2020), 7949-7958. IF: 4.486
Cílená modulace signálních drah v buňce novým typem agonistů muskarinových receptorů, může vést k vývoji léčiv bez vedlejších účinků. (22.7. 2020)
V současné době více než třetina všech léčiv na trhu cílí na receptory v membránách buněk, které jsou spřaženy s vnitrobuněčnými signálními G‑proteiny (tzv. GPCR). Tento typ membránových receptorů se podílí na řízení široké škály fyziologických procesů, počínaje zpracováním smyslových podnětů, přes regulaci chování a nálady, hormonální a imunitní odpovědi až po řízení autonomních funkcí a buněčné proliferace. Proto tyto receptory obecně představují jeden z nejdůležitějších farmakoterapeutických cílů. Tradiční agonisté GPCR aktivují v buňkách obvykle vícero signálních drah, což může mít za následek řadu vedlejších účinků. Látky vedoucí výlučně k aktivaci jedné signální dráhy představují novou generaci vysoce specifických léčiv s méně vedlejšími účinky. Velké úsilí bylo dosud věnováno výzkumu látek vedoucích buď k aktivaci G‑proteinových drah, nebo k signalizační kaskádě přes β‑arrestiny.
V naší laboratoři se zaměřujeme na studium muskarinových acetylcholinových receptorů, které patří k typickým představitelům GPCR. V naší publikaci představujeme zcela nový typ agonistů těchto receptorů, kteří dokážou specificky modulovat signální dráhy na úrovni spřahování receptoru s jednotlivými podtypy G‑proteinů (Obrázek 1A). Zmíněné látky působí výhradně na signální dráhu přes protein Gi, která vede k inhibici adenylát cyklázy a tím ke snížení hladiny cAMP v buňce (Obrázek 1B). Díky tomu jsou tyto látky funkčně selektivní pro muskarinové receptory M2 a M4, jež představují jeden z farmakologických cílů při léčbě bolesti. Nově objevení agonisté mohou vést k vývoji nových analgetik nezpůsobujících návyk jako opiáty, nebo oslabení imunity jako steroidní analgetika. Tato muskarinová analgetika by nezpůsobovala vedlejší účinky zprostředkované aktivací signální dráhy přes protein Gq, jako je inkontinence, nadměrné slinění a pocení a další.
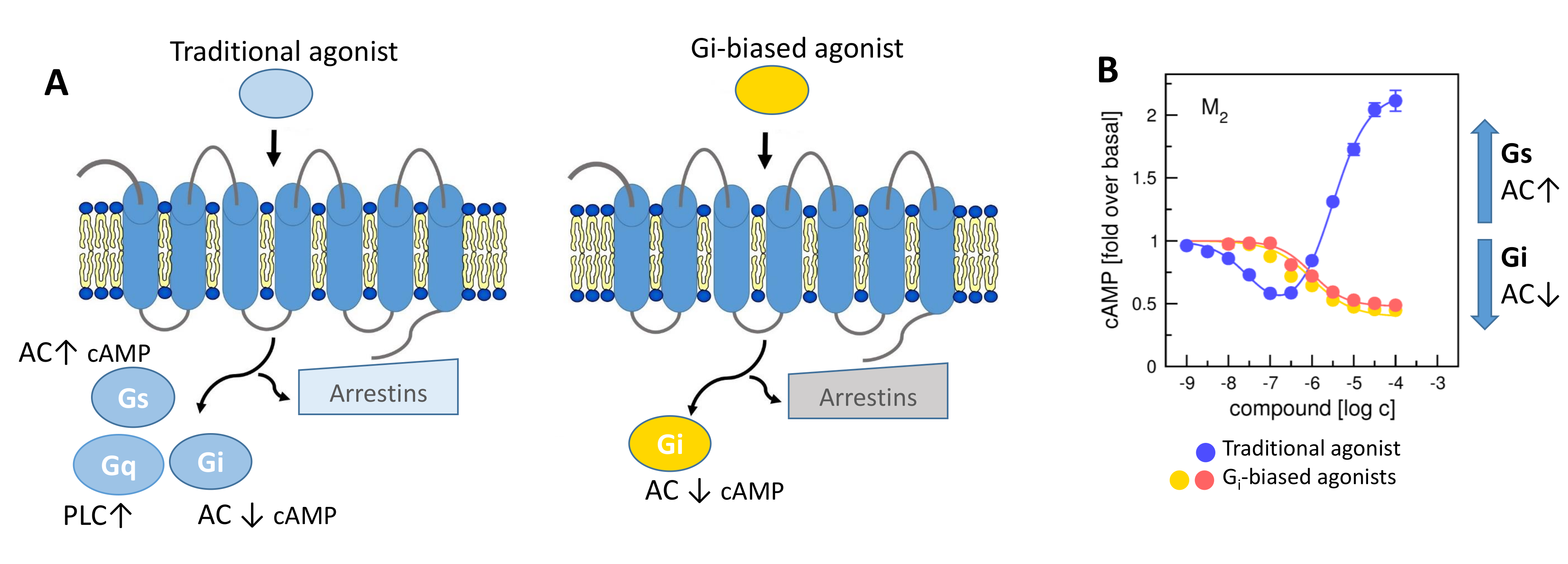
A) Obecné schéma spřahování GPCR s jednotlivými podtypy G-proteinů nebo arrestiny po aktivaci agonistou tradičního typu (vlevo) a agonistou preferujícím aktivaci Gi-proteinu (vpravo). AC, adenylát cykláza; PLC fosfolipáza C. B) Aktivace M2 receptoru tradičním agonistou (modře) stimulujícím Gi i Gs-proteinovou dráhu, což vede ke snížení hladiny cAMP v buňce při nízkých koncentracích agonisty a k nárůstu koncentrace cAMP při vyšších koncentracích agonisty. Aktivace M2 receptoru dvěma různými Gi-preferujícími (Gi-biased) agonisty (červeně, oranžově) stimulujícími pouze Gi-proteinovou dráhu, což vede pouze ke snížení hladiny cAMP.
Randáková A, Nelic D, Ungerová D, Nwokoye P, Su Q, Doležal V, El-Fakahany EE, Boulos J, Jakubík J. Novel M2-Selective, Gi-Biased Agonists of Muscarinic Acetylcholine Receptors. British Journal of Pharmacology. 2020; 177(9); 2073-2089 . IF: 7.730
Koncentrace bioaktivního lipidu 5-PAHSA jsou regulovány enzymaticky a připravují tukovou tkáň na syntézu mastných kyselin. (22.7. 2020)
5-PAHSA patří mezi nově objevené lipidy, které jsou příslibem pro léčbu cukrovky a zánětlivých onemocnění, avšak detaily jejich působení nejsou známy. Experimenty na myších a lidských buňkách prokázaly, že 5-PAHSA dokáže podobně jako inzulin dopravit cukr do buněk, avšak poté už funguje odlišně. Zatímco inzulin podněcuje ukládání tuků, 5-PAHSA aktivuje energeticky náročnější metabolickou dráhu, při níž vznikají nové mastné kyseliny. Přijaté cukry se tak využívají metabolicky prospěšněji.

Ovlivnění metabolismu cukrů a lipidů bioaktivním lipidem 5-PAHSA. Pomocí značení metabolických drah a moderních analytických metod na myších modelech byl prokázán pozitivní vliv lipidu 5-PAHSA na zpracování glukózy buňkami.
Palůchová V, Oseeva M, Březinová M, Čajka T, Bardová K, Adamcová K, Žáček P, Brejchová K, Balas L,Chodounská H, Kudová E, Schreiber R, Zechner R, Durand T, Rossmeisl M, Abumrad N. A, Kopecký J, Kuda O Lipokine 5-PAHSA is Regulated by Adipose Triglyceride Lipase and Primes Adipocytes for de novo Lipogenesis in Mice . Diabetes. 2020; 69(3); 300-312 . IF: 7.720
Výzkum iontového kanálu TRPA1 může pomoci při objasnění příčin chronické bolesti (3.2. 2020)
Řada závažných onemocnění je doprovázena chronickou bolestí, jejíž molekulární mechanismy nejsou prozatím plně objasněny. Výzkumem iontového kanálu TRPA1, který se uplatňuje v těchto mechanismech, se zabývají vědci z oddělení Buněčné neurofyziologie Fyziologického ústavu AV ČR. Ve spolupráci s laboratoří CBMN Univerzity v Bordeaux prokázali, že aktivita lidského TRPA1 je významně regulována membránovými fosfolipidy na záporných membránových potenciálech. Podařilo se identifikovat vazebné místo TRPA1 kanálu, které interaguje s fosfolipidy při nízkých koncentracích vápenatých iontů. Stejné místo může při vyšších koncentracích vázat regulační protein kalmodulin a modulovat tak iontový kanál způsobem závislým na jeho aktivitě. Tyto nové nálezy naznačují, že pro aktivaci TRPA1 je za fyziologických podmínek důležité správné složení plazmatické membrány zajišťující v oblasti rozhraní mezi podjednotkami převod signálů na otevírání iontového kanálu.

(A) Elektrofyziologické záznamy TRPA1 odpovědí na karvakrol (100 µM) a zvýšenou koncentraci vápenatých iontů (z 0 na 0.5 mM). Záznamy ze dvou F11 buněk snímané pipetou naplněnou (vlevo) kontrolním roztokem a (vpravo) roztokem s přidaným specifickým peptidem T1003-P1034. Dole, navržený mechanizmus, kterým o vazebné místo TRPA1 soutěží kalmodulin (CaM) a fosfolipid (PIP2). (B) Vazebné místo pro fosfolipidy v oblasti rozhraní dvou sousedních podjednotek TRPA1 kanálu. Zobrazena je jen transmembránová část podílející se na vazbě a převodu signalizace do vrátek (gate) kanálu (PDB kód struktury 6pqq). Úloha fenylalaninu Phe1020 v interakci byla prokázána v uvedené studii.
Máčiková L, Sinica V, Kádková A, Villette S, Ciaccafava A, Faherty J, Lecomte S, Alves I. D, Vlachová V Putative interaction site for membrane phospholipids controls activation of TRPA1 channel at physiological membrane potentials . FEBS Journal. 2019; 286(18); 3664-3683 . IF: 4.392
Inovativní metoda regulace Forkhead transkripčního faktoru FOXO3 (29.1. 2020)
Studie otištěná v prestižním časopise eLife identifikuje nízkomolekulární sloučeniny, které interagují s transkripčním faktorem Forkhead box O3 (FOXO3) a modulují tak jeho aktivitu.
Protein FOXO3 s charakteristickou DNA-vazebnou doménou je součástí podtřídy O rodiny Forkhead transkripčních faktorů. Tyto transkripční faktory jsou v savčích buňkách klíčovými regulátory buněčné homeostázy, diferenciace, délky života a řízené buněčné smrti. Aktivita FOXO3 také významně přispívá k rezistenci rakovinných buněk vůči chemo- a radioterapii. Nejnovější studie rovněž ukázaly, že se DNA-vazebná doména (DBD) FOXO proteinů účastní protein-proteinových interakcí s dalšími klíčovými regulátory délky života, buněčné smrti a lékové rezistence. Reverzibilní inhibice aktivity FOXO3 prostřednictvím nízkomolekulárních sloučenin by tak mohla podpořit protinádorové imunitní odpovědi.
K inhibici aktivity FOXO3 bylo nejdříve nezbytné identifikovat nízkomolekulární sloučeniny, které by blokovaly interakci mezi FOXO3 DBD a DNA. Na základě struktury FOXO3 DBD a FOXO4 DBD bylo vytvořeno šest různých farmakoforových modelů, které byly využity pro in silico screening databází nízkomolekulárních sloučenin. U vybraných sloučenin byla následně testována schopnost inhibovat funkci FOXO3 jak in vitro, tak i v nádorových buněčných kulturách. Interakce sloučenin s FOXO3 DBD byly charakterizovány pomocí metod NMR spektroskopie a molekulového dokování.
Týmy dr. Veroniky Obšilové z Fyziologického ústavu AV ČR z BIOCEV a prof. Tomáše Obšila z Přírodovědecké fakulty UK ve spolupráci se skupinou prof. M. J. Ausserlechnera z Medical University Innsbruck, Rakousko identifikovaly sloučeniny S9 a její oxalátovou sůl S9OX jako látky schopné inhibovat FOXO3 v nádorových buňkách. Vědci zároveň vyslovili domněnku, že díky svému způsobu vazby na FOXO3 DBD mohou také S9 sloučeniny bránit protein-proteinovým interakcím mezi FOXO3 a jeho vazebnými partnery. Výhodou těchto látek je, že nejsou imunogenní, což umožňuje nastavení dávky a délky aplikace tak, aby byla posílena protinádorová imunita a zároveň byly omezeny nežádoucí efekty inhibice FOXO proteinů u kmenových buněk a somatických tkání. Další výzkum bude zaměřen na zjištění, jestli lze S9 využít jako základ pro vývoj sloučenin schopných specificky modulovat funkce jednotlivých FOXO transkripčních faktorů.

Sloučeniny S9 blokují DNA-vazebný povrch Forkhead transkripčního faktoru FOXO3. Na obrázku je znázorněn strukturní model DNA-vazebné domény FOXO3 s navázanou sloučeninou S9 založený na datech z měření jaderné magnetické resonance a molekulového dokování.
Hagenbuchner J, Obšilová V, Kaserer T, Kaiser N, Rass B, Pšenáková K, Dočekal V, Alblová M, Kohoutová K, Schuster D, Aneichyk T, Veselý J, Obexer P, Obšil T Ausserlechner; M. J. Modulating FOXO3 transcriptional activity by small; DBD-binding molecules . eLife. 2019; 8(Dec 4)); e48876 . IF: 7.080
Transkripční faktor Hif-1a je nezbytný pro správný vývoj sympatického nervového systému a inervaci srdce (16.1. 2020)
Hypoxií indukovaný faktor 1 (Hif-1) je hlavním regulátorem transkripční odpovědi buněk na sníženou dostupnost kyslíku. Výzkum probíhající v laboratořích Biotechnologického a Fyziologického ústavu AV ČR a 1. Lékařské fakulty UK ukázal, že genetická mutace genu Hif-1a potlačuje embryonální vývoj pregangliových a postgangliových neuronů sympatického nervového systému a negativně ovlivňuje sympatickou inervaci srdce, která hraje primární úlohu při regulaci tepové frekvence a srdeční kontraktility při zátěži. U myši s podmíněnou delecí genu Hif-1a byl zjištěn anomální vývoj architektury koronárního řečiště a snížená kontraktilní funkce srdce. Tyto nové nálezy ukazují, že dysfunkce tohoto transkripčního faktoru může vést k rozvoji závažných kardiovaskulárních onemocnění spojených s poruchou rovnováhy autonomního nervového systému a zároveň otevírají nové možnosti léčby těchto onemocnění v budoucí klinické praxi.

Zhoršený vývoj sympatické inervace srdce s delecí Hif-1a (Hif1aCKO): Immunohistochemická detekce nervových vláken pomocí tyrozin hydroxylázy (TH) a kvantifikace TH-pozitivních vláken u kontrolních and Hif1aCKO srdcí v embryonálním stádiu E16.5.
Bohuslavová, Romana - Čerychová, Radka - Papoušek, František - Olejníčková, Veronika - Bartoš, M. - Goerlach, A. - Kolář, František - Sedmera, David - Semenza, G.L. - Pavlínková, Gabriela: HIF-1 alpha is required for development of the sympathetic nervous system. Proceedings of the National Academy of Sciences of the United States of America. Roč. 116, č. 27 (2019), s. 13414-13423. ISSN 0027-8424, IF: 9.580, 2018.
Zvýšená hladina cukru v krvi způsobuje sekreci hormonu inzulínu z β-buněk Langerhansových ostrůvků v slinivce břišní (15.1. 2020)
Zvýšená hladina cukru v krvi způsobuje sekreci hormonu inzulínu z β-buněk Langerhansových ostrůvků v slinivce břišní. Tato odpověď je řízena tzv. redoxní signalizací, přičemž mírně zvýšená hladina reaktivních kyslíkových sloučenin (ROS), např. H2O2, spustí regulaci proteinových kaskád, která vyústí v sekreci inzulinu z inzulinových granulí v b-buňkách. Nadměrná produkce ROS však způsobuje patologický oxidativní stres, který provází řadu nemocí, včetně cukrovky 2. typu. Oxidativní stres lze snížit posílením antioxidační obrany buněk. Mitochondrie jsou důležité energetické továrny všech buněk a taktéž jeden z hlavních zdrojů produkce ROS. V naší práci jsme testovali účinek třech nových antioxidačních molekul (SkQ, S3QEL a S1QEL) působících v mitochondriích b-buněk na místech produkce ROS. Odhalili jsme podrobně mechanismus působení těchto látek, které na různých místech v mitochondriích specificky zabraňují tvorbě ROS a mohou mít roli antioxidační, ale i pro-oxidační v závislosti na energetickém metabolismu buňky a na dostupnosti energetického substrátu (např. přítomnosti glukózy). Například antioxidant SkQ působí v b-buňkách jako antioxidant především při nadbytku energetického substrátu, což znamená in vivo po jídle. Naopak, při hladovění, se SkQ chová krátkodobě jako pro-oxidační molekula a zvyšuje již přítomný oxidační stres. Detailní znalost mechanismu působení těchto antioxidačních molekul v β-buňkách slinivky může pomoci v léčbě cukrovky.

Obrázek možného účinku SkQ: Navržený mechanismus antioxidační aktivity mitochondriálně cíleného SkQ: (a) antioxidační dvouelektronová redukce SkQ na SkQH2 a jeho regenerace (oxidace SkQH2) na elektron transportním komplexu I mitochondrií, na základě reference [1]; (b) antioxidační dvou elektronová redukce SkQ na SkQH2 na elektron transportním komplexu III mitochondrií a regenerace na komplexu I, na základě reference [1]
Plecitá-Hlavatá; Lydie - Engstová; Hana - Ježek; Jan - Holendová; Blanka - Tauber; Jan - Petrásková; Lucie - Křen; Vladimír - Ježek; Petr . Potential of Mitochondria-Targeted Antioxidants to Prevent Oxidative Stress in Pancreatic beta-cells . Oxidative Medicine and Cellular Longevity. 2019; 2019(2019)); 1826303 . IF = 4.868.
Načíst další









