Nové poznatky o struktuře komplexu FOXO4: p53 – klíčového faktoru v regulaci stárnutí buněk (22.4. 2022)
NOVÁ PUBLIKACE
Transkripční faktor p53 brání tomu, aby se vlivem stresu staly z normálních buněk buňky nádorové. Za stresových podmínek p53 interaguje s dalším transkripčním faktorem FOXO4 (Forkhead box O 4) a společně pak zvyšují produkci proteinu p21, což spouští proces stárnutí buňky (senescenci). Molekulární mechanismus zvyšování transkripce p21 je však stále nejasný. V práci publikované v časopise Protein Science vědecké týmy Dr. Obšilové (FGÚ AV ČR), prof. Obšila (PřF UK a FGÚ AV ČR) a jejich kolegů z ÚOCHB AV ČR charakterizovali vzájemné interakce proteinů p53 a FOXO4 na molekulární úrovni. Nové poznatky o struktuře komplexu naleznou využití při vývoji specifických inhibitorů interakce mezi oběma proteiny, a následně pak při vývoji nových léčiv zaměřených na selektivní eliminaci senescentních buněk.
V této strukturní studii vědci provedli podrobnou charakterizaci interakcí v komplexu FOXO4:p53 pomocí integrovaného přístupu zahrnujícího analytickou ultracentrifugaci, nukleární magnetickou rezonanci a chemické zesítění spojené s hmotnostní spektrometrií. Protože FOXO4 i p53 mají více domén (viz. obrázek), studovali roli jednotlivých domén a neuspořádaných segmentů obou proteinů a zmapovali jejich interakční rozhraní. Zjistili, že zcela zásadní pro celkovou stabilitu komplexu p53:FOXO4 je interakce mezi transaktivační doménou TAD p53 a Forkhead doménou FOXO4. Na tvorbě komplexu se dále podílejí kontakty zahrnující N-koncový neuspořádaný segment FOXO4, C-koncovou negativní regulační doménu p53 a DNA-vazebné domény obou proteinů. Měřením vazby na DNA dále zjistili, že tvorba komplexu p53:FOXO4 blokuje vazbu p53 na DNA, aniž by však ovlivnila DNA-vazebné vlastnosti FOXO4.
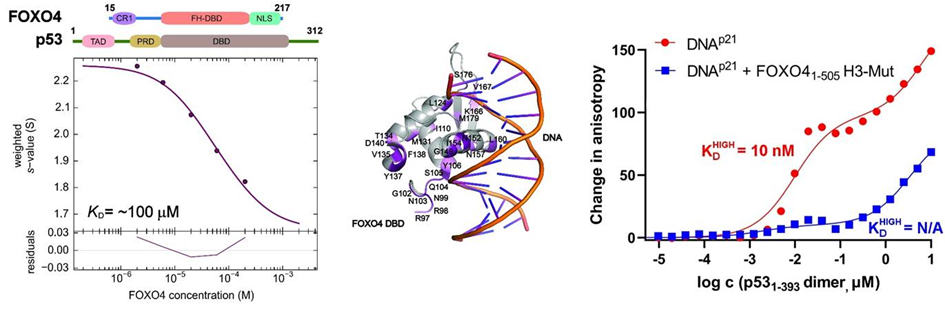
Vlevo, analýza interakce mezi FOXO4 a p53 pomocí analytické ultracentrifugace, metodou sedimentační rychlosti. Uprostřed, změny v chemických posunech 15N-značeného FOXO4 v přítomnosti p53 získané z 1H-15N HSQC spekter namapované na krystalovou strukturu komplexu FOXO4 DBD:DNA. Vpravo, měření změn anisotropie fluorescence ukazující, že tvorba komplexu inhibuje vazbu p53 na DNA.
Mandal R, Kohoutova K, Petrvalska O, Horvath M, Srb P, Veverka V, Obsilova V and Obsil T. FOXO4 interacts with p53 TAD and CRD and inhibits its binding to DNA. Protein Sci. roč. 31, č. 5 (2022), č. článku e4287. IF = 6.725. DOI
NOVÁ PUBLIKACE
Orální glukózový toleranční test (OGTT) je nejběžněji používaným nástrojem na diagnostiku cukrovky z kapky krve. Pomocí něj můžeme sledovat schopnost organismu snížit hladinu cirkulující glukózy, která byla podána nalačno. Přestože jsou dynamické změny hladiny glukózy v krvi během OGTT dobře známy, málo se ví o metabolických změnách v cílových orgánech nebo o jejich vzájemné komunikaci. V naší studii jsme zkoumali, co se děje s molekulami cukru v jednotlivých orgánech a jak cukr ovlivňuje metabolické dráhy v těle. Proto jsme na myším modelu provedli OGTT s využitím glukózy značené stabilním izotopem uhlíku (13C), analyzovali jsme distribuci 13C6-glukózy v tkáních a sledovali časové profily metabolitů a lipidů napříč 12 orgány a v plasmě. Zjistili jsme, že se během OGTT využití glukózy zapíná na úrovni jednotlivých orgánů se specifickou kinetikou, ale substráty hladovění, jako je β-hydroxybutyrát, jsou “vypnuty” ve všech orgánech najednou. Časové profily 13C značených mastných kyselin a triacylglycerolů v tkáních naznačují, že se hnědá tuková tkáň může výrazně podílet na hladinách cirkulujících mastných kyselin paradoxně v momentě, kdy jsou hodnoty glukózy v plazmě nejvyšší. Vytvořili jsme virtuální interaktivní atlas metabolitů (cukrů, aminokyselin, lipidů..), který popisuje vzájemné vztahy mezi orgány po požití dávky cukru. Metabolický osud glukózy byl sledován ve 12 tkáních a plasmě.

Navštivte interaktivní webovou aplikaci, kde můžete virtuální myš prozkoumat sami.
Lopes M, Brejchova K, Riecan M, Novakova M, Rossmeisl M, Cajka T, Kuda O. Metabolomics atlas of oral 13C-glucose tolerance test in mice. Cell Rep. 2021 Oct 12;37(2):109833. DOI. PMID: 34644567 IF = 9,423
Účinnost opioidních analgetik je potlačena chemokinem CCL2 (8.12. 2021)
Opioidní analgetika jsou standardně využívána při léčbě závažných bolestivých stavů. Velmi obtížná je ale léčba neuropatických bolestí, které vznikají při poškození nervového systému a opioidní analgetika jsou zde často neúčinná. Je známo, že za těchto neuropatických stavů dochází na úrovni míchy k zánětu a zvýšené produkci určitých signálních molekul (chemokinů), jako je CCL2. Současná práce ukazuje, že chemokin CCL2 je jedním z důležitých faktorů významně snižujících účinnost analgetik působících přes opioidní receptory. Pravděpodobně působí jak přímo na neurony, tak přes aktivaci mikrogliových buněk. Léčba opioidními analgetiky je spojena také s celou řadou závažných nežádoucích účinků. Jedním z nich je i paradoxní zvýšená bolestivost – hyperalgezie, po podání opioidů. Tato práce ukazuje, že zmíněná nežádoucí hyperalgezie může být způsobena aktivací TRPV1 receptorů. Celkově publikované výsledky naznačují, že cestou ke zlepšení účinnosti léčby opioidními analgetiky, zejména při neuropatických stavech, by mohlo být současné ovlivnění funkce chemokinu CCL2 a TRPV1 receptorů.

Vliv CCL2 na utlumení bolestivého (nociceptivního) signálu opioidními agonisty v zadním rohu míšním. Kontrolní modrá křivka ukazuje, jak je synaptický přenos nociceptivního signálu po přidání látky DAMGO výrazně utlumen a zhruba po 13 minutách naopak posílen. DAMGO je agonista µ opiodních receptorů a napodobuje tedy účinek opiodních analgetik. Analgetický účinek DAMGO je však zcela potlačen v přítomnosti chemokinu CCL2 (červená křivka). Fialová křivka ukazuje, že CCL2 působí prostřednictvím mikrogliálních buněk, protože ztrácí svůj účinek, pokud jsou mikroglie blokovány přídavkem minocyklinu.
Chemokine CCL2 preventsopioid‑inducedinhibitionofnociceptivesynaptictransmission in spinalcorddorsalhorn. Mario Heles, Petra Mrozkova, Dominika Sulcova, Pavel Adamek, Diana Spicarova and Jiri Palecek, JournalofNeuroinflammation (2021) 18:279, DOI, IF=8.23
Oddělení výzkumu bolesti, Fyziologický ústav AV ČR, Akademie věd České republiky, Vídeňská 1083, 142 20 Praha 4, Česká republika
Glifloziny – víc než jen antidiabetika (8.12. 2021)
Glifloziny se dnes běžně předepisují jako léčiva proti diabetu (pacienti možná budou znát např. empagliflozin pod obchodním názvem Jardiance). Glifloziny inhibují činnost transportéru pro sodík a glukózu v ledvinách, čímž zvyšují vylučování glukózy močí a pomáhají tak udržet hladiny krevního cukru. Vedle úlevy od zvýšené glykémie byla u pacientů pozorována i řada dalších příznivých účinků gliflozinů mj. snížení hmotnosti, krevního tlaku, či funkce ledvin a to nejen u lidí s diabetem ale i bez diabetu. Jak je to možné? Tady nastala ta pravá chvíle udělat krok zpět a charakterizovat účinky těchto léků znovu a důkladně u modelových zvířat. Výzkumný tým dr. Vaněčkové a její kolegové z dvou dalších oddělení z Fyziologického ústavu ve spolupráci s dr. Malínskou z IKEM zkoumali účinky empagliflozinu u různých nediabetických potkaních modelů vyznačujících se sklony k vysokému krevnímu tlaku (Ren-2 transgenní potkani, TGR) nebo k poruchám lipidového metabolismu (hereditárně triglyceridemičtí potkani). Ačkoli se přínos léčby u jednotlivých modelů v detailech lišil, dosažené výsledky ukazují, ze empagliflozin působí protizánětlivě, normalizuje hladiny krevních i tkáňových lipidů a u TGR potkanů navíc tlumí aktivitu sympatického nervového systému, čímž dochází ke snížení krevního tlaku. Tyto poznatky mohou v budoucnu přispět k rozšíření použití gliflozinu i na jiné diagnózy, než je stávající diabetes.


Hojná S, Rauchová H, Malínská H, Marková I, Hüttl M, Papoušek F, Behuliak M, Miklánková D, Vaňourková Z, Neckář J, Kadlecová M, Kujal P, Zicha J, Vaněčková I. Antihypertensive and metabolic effects of empagliflozin in Ren-2 transgenic rats, an experimental non-diabetic model of hypertension. Biomed Pharmacother. 2021 Dec;144:112246. Epub 2021 Oct 1. IF-5,98, DOI
Cílená modulace NMDA receptorů je klíčová pro efektivní léčbu neurologických a neurovývojových onemocnění (14.10. 2021)
N-methyl-D-aspartátové (NMDA) receptory jsou glutamátem aktivované iontové kanály, které se zásadně podílejí na excitačním synaptickém přenosu a jsou klíčové pro procesy učení a paměti. Jejich narušená funkce vede k závažným neurologickým, neurovývojovým a psychiatrickým chorobám jakými jsou například schizofrenie, poruchy autistického spektra, epilepsie či Alzheimerova choroba. Pro efektivní návrh nových léčiv schopných cíleně modulovat NMDA receptory je nezbytné detailně porozumět nejen struktuře receptoru na atomární úrovni, ale rovněž i odhalit konkrétní sekvenci konformačních změn, které se uplatňují při jeho aktivaci a alosterické modulaci.
Za využití metody single-molecule FRET jsme popsali a kvantifikovali sekvenci konformačních změn NMDA receptoru v jeho amino-terminální doméně, které za fyziologických podmínek vedou k aktivaci receptoru. V neposlední řadě jsme pak odhalili rozdílné úlohy receptorových podjednotek při aktivaci receptoru a identifikovali molekulární mechanismus, jakým snížení pH za patofyziologických podmínek (např. při mrtvici) vede ke snížení funkce receptoru.

Vyklický, Vojtěch - Stanley, Ch. - Habrian, Ch. - Isacoff, E. Y. Conformational rearrangement of the NMDA receptor amino-terminal domain during activation and allosteric modulation. Nature Communications. Roč. 12, č. 1 (2021), č. článku 2694. ISSN 2041-1723. E-ISSN 2041-1723, IF: 14.919, rok: 2020, DOI
Načíst další






