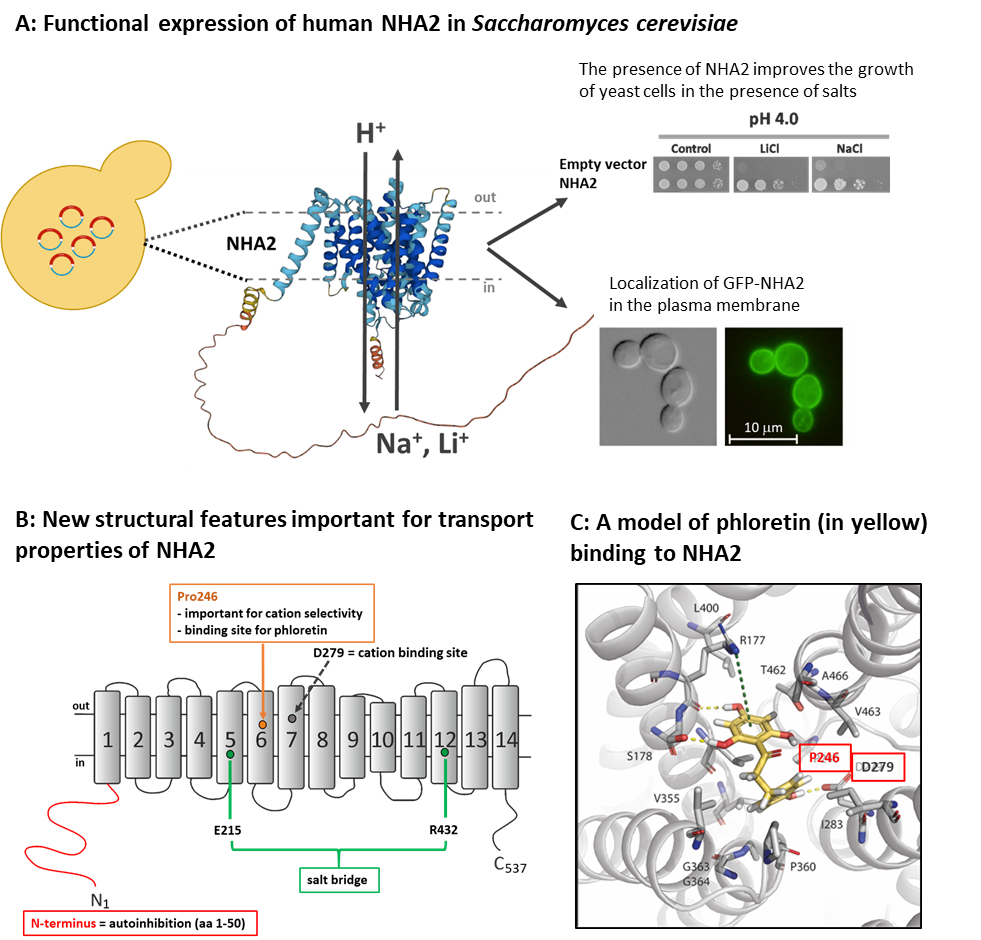
Sodno/protonové antiportery jsou membránové proteiny, které se nacházejí ve všech živých buňkách od bakterií až po člověka a hrají důležitou úlohu v regulaci pH a koncentrací kationtů uvnitř buněk. Mezi tyto typy transportérů patří i antiporter NHA2, jehož aktivita ovlivňuje řadu fyziologických funkcí, např. sekreci inzulínu, zpětné vstřebávání sodíku v ledvinách nebo pohyblivost spermií. Antiporter NHA2 transportuje přes membránu kationty Na+ nebo Li+ výměnou za H+ a jeho aktivita je specificky inhibována phloretinem. Vlastnosti a funkce všech proteinů přímo vyplývají z jejich složení, tedy ze sekvence aminokyselin, které protein tvoří. V rodině antiporterů Na+/H+ má NHA2 jedinečnou strukturu. Skládá se z 537 aminokyselin uspořádaných do 14ti transmembránových domén a unikátního hydrofilního N-konce dlouhého 82 aminokyselin, jehož struktura a funkce nebyly dosud studovány. V časopise Protein Science jsme publikovali objev nových prvků ve struktuře NHA2 důležitých pro jeho funkci, včetně odhalení významné regulační úlohy N-konce proteinu.
Lidský protein NHA2 a jeho mutantní varianty jsme studovali pomocí jeho exprese v buňkách modelového eukaryotního organismu, kvasince Saccharomyces cerevisiae, a také pomocí bioinformatických simulací (ve spolupráci s laboratoří Prof. Nira Ben-Tala z Univerzity v Tel-Avivu). Identifikovali jsme několik nových aminokyselinových zbytků důležitých pro selektivitu antiporteru (rozpoznání a transport kationtů Na+ a Li+) a pro transport protonů. Dále jsme určili místo ve struktuře proteinu, kam se váže inhibitor phloretin. Odhalili jsme také, že unikátní hydrofilní N-koncová část proteinu má důležitou (autoinhibiční) úlohu v regulaci transportní aktivity NHA2, protože zkrácení N-konce o prvních 50-70 aminokyselin vedlo až k dvojnásobnému zvýšení transportní aktivity proteinu. Dosažené výsledky také ukazují, že expresní systém NHA2 v buňkách kvasinek je možné v budoucnu využít např. pro rychlé zjištění, jak mutace vyskytující se v NHA2 v lidském genomu ovlivňují aktivitu antiporteru a/nebo pro testování nových látek ovlivňujících funkci NHA2 podobně jako phloretin.
Velazquez D., Prusa V., Masrati G., Yariv E., Sychrova H., Ben-Tal N. and Zimmermannova O. (2022): Allosteric links between the hydrophilic N-terminus and transmembrane core of human Na+/H+ antiporter NHA2. Protein Sci: e4460. IF = 6.993 DOI