Pro zdárný vývoj embrya je klíčová délka buněčného cyklu
26. 10. 2023
Vědcům z Ústavu živočišné fyziologie a genetiky AV ČR se podařil zásadní objev v pochopení procesu vývoje zdravého embrya z oplozeného vajíčka. Zjistili, že pro zdárný vývoj myšího zárodku je ve stadiu dvoubuněčného embrya zásadní prodloužení jedné přípravné fáze buněčného cyklu. Popsali také protein, který regulaci délky buněčného cyklu řídí. Pokud ve vajíčku tento CHK1 protein chybí, nedojde ke zdárnému vývoji do blastocysty a embryo zanikne. Výsledky mohou přinést obrovský pokrok v léčbě neplodnosti.
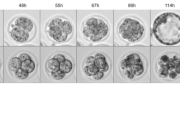
Během embryonálního vývoje nastává podstatný moment: dvě vysoce rozlišené buňky – vajíčko a spermie – se přemění na buňky, z nichž může vzniknout budoucí organismus. Podmínkou je, že se změní na blastomery, což jsou transkripčně aktivní a totipotentní buňky, ve kterých se opět nastartuje transkripce, tedy přepis nové RNA z DNA matky i otce.
Tento náročný proces je spojen s přizpůsobením buněčného cyklu, včetně prodloužení nebo zkrácení mezer mezi jednotlivými děleními. „Tyto procesy probíhají u dvoubuněčných myších embryí v tzv. G2 fázi, která je u nich prodloužená až na 16 hodin. Dokázali jsme, že právě prodloužení této fáze, která nastává po zdvojení genetické informace před dalším dělením, je zcela zásadní pro ochranu celistvosti DNA v embryích – její zkrácení má fatální následky vedoucí k zániku embrya,“ popisuje výsledky práce vedoucí vědeckého týmu Dávid Drutovič z Ústavu živočišné fyziologie a genetiky AV ČR.
Uspíšený nástup dalšího buněčného dělení vede k neplodnosti
Zejména u savců dosud nebylo známo, co změny délky buněčného cyklu reguluje a jak tato regulace chrání DNA buňky před poškozením. „My jsme zjistili, že extrémně dlouhou G2 fázi u dvoubuněčných embryí reguluje protein CHK1 známý jako checkpoint kináza 1, a hraje tak zásadní roli v načasování, kdy buňky přejdou do další fáze dělení. Embrya, která měla odstraněný CHK1 protein, měla tuto G2 fázi výrazně zkrácenou a začala se dále dělit mnohem dříve. Právě toto uspíšené dělení mělo zásadní význam na kvalitu DNA. Rychleji se dělící embrya totiž měla v drtivé většině poškozenou DNA nebo u nich došlo k poruchám v rozdělení množství DNA do dceřiných buněk, což vedlo ke zhoršenému vývoji a zániku embrya,“ vysvětluje Dávid Drutovič.
Tento zcela zásadní objev v pochopení řízení správného dělení buněk při vzniku nového embrya je významným krokem vpřed ve vědeckém poznání v oblasti embryonálního vývoje a buněčné regulace. Může tak otevřít nové cesty k léčbě reprodukčních poruch a vývojových onemocnění. „Naše výsledky mohou mít podstatný význam pro pochopení příčin neplodnosti u lidí. Věříme, že je v budoucnu půjde převést i do praxe v centrech pro asistovanou reprodukci,“ dodává Dávid Drutovič.
Nepostradatelná role SPIM mikroskopie v odhalení prodloužené G2 fáze u embryí
Vědcům tento významný objev umožnila kombinace pokročilé mikroskopické technologie nazývané SPIM (Single Plane Illumination Microscopy) a genetického modelování myší. SPIM je metoda mikroskopie, díky níž lze pozorovat vzorky s vysokým rozlišením a zároveň minimalizovat jejich poškození způsobené expozicí světla.
Odborníci technologii upravili speciálně pro pozorování vývoje savčích vajíček a embryí, což jim umožnilo dosáhnout násobně vyšší přesnosti a prodloužené doby pozorování ve srovnání s klasickými konfokálními mikroskopy.
„Díky této unikátní technologii, kterou máme na našem pracovišti k dispozici, jsme mohli odhalit prodlouženou G2 fázi u dvoubuněčných embryí. Zároveň jsme využili speciálně upravený kmen myší, který měl odstraněný protein CHK1, díky čemuž jsme odhalili, že tento protein je klíčový pro načasování dělení v buňce, a mohli studovat následky zkrácení G2 přípravné fáze na kvalitu DNA v embryích,“ popisuje Dávid Drutovič unikátní vybavení.
Kontakt:
RNDr. Dávid Drutovič, Ph.D.
Laboratoř integrity DNA
Ústav živočišné fyziologie a genetiky AV ČR
drutovic@iapg.cas.cz
RNDr. Barbora Vošlajerová, Ph.D.
Ústav živočišné fyziologie a genetiky AV ČR'
voslajerova@iapg.cas.cz
Přečtěte si také
- Mravenci mají nejraději cukr a olej. Mezinárodní tým vedený objasnil hmyzí chutě
- Nové proboštství na Pražském hradě má moderní vizáž, přesto ctí minulost
- Středoškoláci si mohou vyzkoušet práci vědců. AV ČR vypsala roční stáže
- Do Prahy přijedou přední světoví odborníci na dějiny holokaustu
- Nový typ imunitní odpovědi proti bakteriím ve střevě
- Genová terapie dokáže obnovit růst axonů u poraněné míchy
- Vědci popsali, jak buňka skládá molekulární nůžky na stříhání RNA
- Pět mladých vědců zakládá v AV ČR nové výzkumné skupiny
- Český sociálněvědní datový archiv slaví čtvrt století služby sociálním vědám
- Nově objevené mutace se podílejí na rozvoji leukémie
Kontakty pro média
Markéta Růžičková
vedoucí Tiskového oddělení
+420 777 970 812
Eliška Zvolánková
+420 739 535 007
Martina Spěváčková
+420 733 697 112