Schopnost transportovat kationty K+ a tím i fyziologickou úlohu Na+/H+ antiporterů ovlivňuje složení jejich hydrofilních C-konců (31.1. 2024)
Pro každou buňku je důležité neustále kontrolovat iontové složení svého vnitřního prostředí (cytoplasmy). Má-li odolávat vysokým koncentracím solí (např. NaCl), musí být schopna se zbavovat kationtů sodíku (Na+). Výstup kationtů draslíku (K+) ven z buňky zase souvisí s regulací vnitrobuněčného pH a membránového potenciálu. Transport těchto kationtů ven z buňky výměnou za protony zajišťují v buňkách všech eukaryotických organismů, od jednobuněčných kvasinek až po člověka, tzv. Na+/H+ antiportery. Pro případné farmakologické zásahy do iontové rovnováhy buňky je nutné rozluštit na molekulární úrovni, jak struktura antiporteru ovlivňuje jeho funkce.
Na+/H+ antiportery se jako většina membránových proteinů skládají z části, která se nachází v membráně a části orientované do cytoplasmy - hydrofilního C-konce (viz. obrázek). Dosud se předpokládalo, že to, které ionty budou antiporterem přenášeny, určuje pouze transmembránová část. V naší nové práci však demonstrujeme, že pro určení substrátové specificity (zejména schopnosti transportovat K+) je důležité i složení hydrofilního C-konce antiporteru.
Pro studii jsme konkrétně využili jednobuněčný modelový organismus eukaryotních buněk – kvasinku Saccharomyces cerevisiae, ve které jsme exprimovali antiporter Sod2-22 z osmotolerantní kvasinky Zygosaccharomyces rouxii, který účinně exportuje z buněk pouze kationty Na+ a Li+, ale ne K+. Zjistili jsme, že záměna pouze jedné aminokyseliny (zavedení záporně nabitého zbytku nebo odstranění kladně nabitého zbytku) v jedné z C-koncových konzervovaných oblastí (C3) umožnila tomuto antiporteru transportovat i K+. Zkrácení nebo nahrazení C-terminální části ZrSod2-22 C-koncem z jiného K+-transportujícího antiporteru (S. cerevisiae Nha1 nebo Z. rouxii Nha1) také vedlo k antiporteru s kapacitou exportovat K+. Tato práce poskytuje řadu nových poznatků o vztahu mezi strukturou a funkcí v rodině Na+/H+ antiporterů v eukaryotních buňkách.
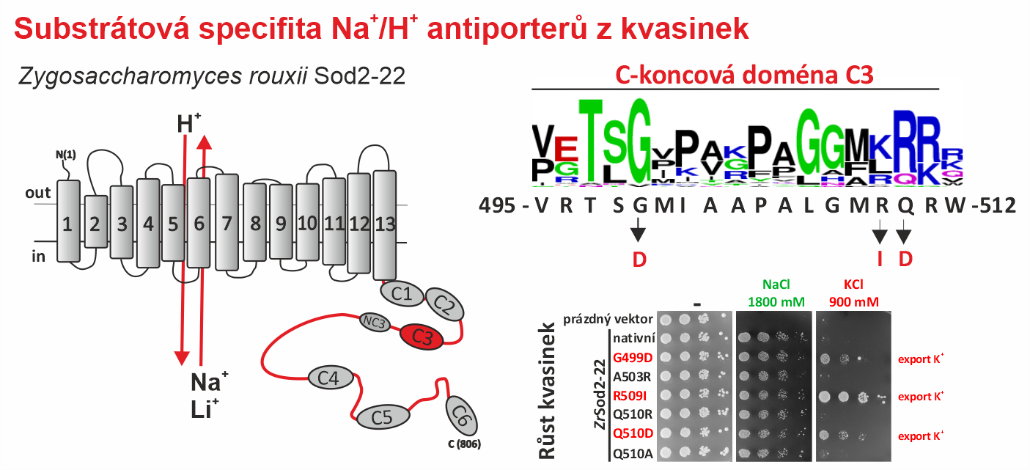
Vlevo: Topologický model Na+/H+ antiporteru z kvasinky Z. rouxii s vyznačenými konzervovanými doménami v hydrofilním C-konci. Vpravo: Mutace jednotlivých zbytků v konzervované doméně C3 změnily substrátovou specifitu antiporteru a umožnily mu zprostředkovat export K+ (demonstrováno růstem buněk exprimujících tyto mutované verze v přítomnosti KCl).
Zimmermannova O., Velazquez D., Papouskova K., Prusa V., Radova V., Falson P., Sychrova H.: The hydrophilic C-terminus of yeast plasma-membrane Na+/H+ antiporters impacts their ability to transport K+. J Mol Biol. 436, 168443 (2024). IF = 5.6 DOI
Frekvenční kódování představuje základní hypotézu vysvětlující způsob přenosu informace mezi nervovými buňkami. Tato hypotéza je založena na pozorování, že průměrná četnost (frekvence) akčních potenciálů vzrůstá s intenzitou stimulace. Avšak přesné časy akčních potenciálů bývají proměnlivé i při zachování identických podmínek. Při vyhodnocování experimentálních dat i teoretických simulací je tedy nutné kvantifikovat variabilitu opakovaných záznamů, a posoudit tak spolehlivost frekvenčního kódováni. Variabilita neuronálních záznamů se obvykle měří pomocí tzv. Fano faktoru, jehož odhad je považován za problematický, zvláště při omezeném množství dat. V tomto článku navrhujeme novou metodu, pomocí níž je možné odhadnout Fano faktor přesněji než pomocí standardních metod, a to i v případě značné proměnlivosti stimulace v čase.

Rajdl K, Košťál L: Estimation of the instantaneous spike train variability. Chaos Solitons & Fractals. Roč. 177, December (2023), 114280. ISSN 0960-0779. E-ISSN 1873-2887 IF: 7.8 DOI
Jakým způsobem blokuje protein 14-3-3 aktivitu proteinkinasy CaMKK? (16.1. 2024)
Proteinkinasy CaMKK1 a CaMKK2 regulují klíčové fyziologické a patologické procesy, jako jsou nádorové bujení, morfogeneze neuronů, synaptická plasticita, aktivace transkripčních faktorů, homeostáza buněčné energie či podpora přežití buněk. Podařilo se nám objasnit strukturní podstatu inhibice obou CaMKK kinas prostřednictvím regulačních proteinů 14-3-3. Ukázali jsme, že vazba proteinu 14-3-3 na CaMKK1 i CaMKK2 brání jejich interakci s kalmodulinem, signální molekulou, která je nezbytná pro jejich aktivitu. Objasnění struktur komplexů 14-3-3 s CaMKK také odhalilo, že v případě CaMKK1 dochází navíc k blokaci katalytického centra enzymu C-koncovými helixy proteinu 14-3-3. Naše zjištění mohou pomoci při vývoji nových léčiv cílených na inhibici CaMKK kinas.

Dimer proteinu 14-3-3 blokuje katalytické centrum CaMKK1 kinasy. Aktivní centrum kinasy je znázorněno pozicí inhibitoru (žlutě), fosforylační místa CaMKK1 jsou znázorněna červeně.
Petrvalska O+, Honzejkova K+, Koupilova N, Herman P, Obsilova V*, Obsil T.* 14-3-3 protein inhibits CaMKK1 by blocking the kinase active site with its last two C-terminal helices. Protein Sci. 32 (2023):e4805. ISSN 0961-8368. E-ISSN 1469-896X, IF: 8.000 DOI
+ shared first authorship * shared corresponding autorship
Nejčastějším narušením cirkadiánních rytmů v moderní společnosti je tzv. sociální jetlag, tedy chronický nesoulad mezi biologickým časem (chronotypem) a sociálním časem (například vstávání podle budíku). Zda má sociální jetlag nějaké negativní účinky na zdraví, však není zcela jasné. Velká studie na reprezentativní dospělé populaci ČR provedená vědci z Oddělení biologických rytmů Fyziologického ústavu AV ČR a publikovaná v časopise Sleep odhalila rizikové faktory pro vývoj kardiovaskulárních a metabolických onemocnění, které jsou spojené s nesprávně nastaveným spánkovým režimem.
Autoři studie zkoumali unikátní populačně-reprezentativní soubor dat zahrnující 1957 krevních vzorků dospělých lidí z celé ČR s různými denními režimy (chronotypem). Ve vzorcích bylo analyzováno devět biomarkerů (cholesterol, krevní lipidy, glukóza, kortizol, a další) a byla zjištěna souvislost mezi sociálním jetlagem a biomarkery kardio-metabolického zdraví (hladinou celkového cholesterolu a LDL), která byla statisticky významná především u lidí starších 50 let. Autoři ve studii identifikovali i nové faktory ovlivňující sociální jetlag, jako je doba dojíždění do školy či zaměstnání nebo stres z nedostatku času. Studie také prokázala, že flexibilní pracovní doba účinně zmírňuje sociální jetlag.

Sládek M, Klusáček J, Hamplová D, Sumová A: Population-representative study reveals cardiovascular and metabolic disease biomarkers associated with misaligned sleep schedules. Sleep, Volume 46, Issue 6, June 2023, zsad037, IF: 5.6 DOI
Jak si buňky zajistí dostatek draslíku? (17.5. 2023)
Optimálně vysoká koncentrace draselných iontů je nezbytná pro mnoho buněčných procesů. Proto buňky používají celou řadu trasnportních proteinů s jejichž pomocí regulují vstup a výstup draselných iontů. Jedním z transportérů K+ do buněk je protein Trk1. S použitím kvasinkových buněk jsme prokázali, že velmi krátká část proteinu, smyčka IL2 a její dva konzervované zbytky (serin 882 a threonin 900) hrají důležitou úlohu jak ve správném poskládání proteinu při jeho vzniku, tak při regulaci aktivity proteinu v odpovědi na měnící se vnější koncentrace draselných iontů. Pro tuto regulaci je důležitá vazba regulačních proteinů nazývaných 14-3-3 na fosforylovaný threonin 900.
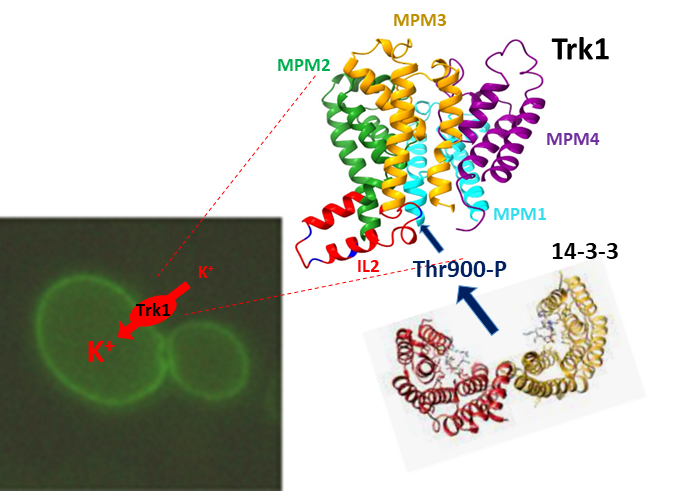
Proteiny 14-3-3 regulují aktivitu Trk1 vazbou na Thr900 ve druhé vnitrobuněčné smyčce proteinu.
Masaryk J, Kale D, Pohl P, Ruiz-Castilla F, Zimmermannová O, Obšilová V, Ramos J, Sychrová H: The second intracellular loop of the yeast Trk1 potassium transporter is involved in regulation of activity, and interaction with 14–3-3 proteins. Computational and Structural Biotechnology Journal. 21 (2023), 2705-2716. ISSN 2001-0370. E-ISSN 2001-0370, IF: 6.155 DOI
Načíst další





