Tkáňové inženýrství náhrad cév a srdečních chlopní
Návrh harmonogramu týdenního kurzu: „Tkáňové inženýrství náhrad cév a srdečních chlopní“
Úvod do problematiky:
Tkáňové inženýrství je mezioborová disciplína, která podle dnes již klasické definice Langera a Vacantiho z roku 1993 „využívá principy technických a biologických vědních oborů pro vývoj biologické náhrady, která obnoví, zachová nebo zlepší funkci tkáně či celého orgánu“. Jmenovaná biologická náhrada pak obsahuje dvě základní složky: buňky a jejich nosič, který by se měl chovat jako analog extracelulární matrix (ECM), tedy řídit adhesi, růst, diferenciaci a specifické funkce buněk. Nosičem buněk mohou být buď skutečné molekuly ECM, jako je kolagen, elastin, fibronektin, laminin i fibrin, tj. molekula dočasné ECM), nebo umělé materiály, především syntetické polymery, keramické materiály, materiály založené na uhlíku, kovy i materiály kompozitní, tj. obsahující dvě či více uvedených složek. Jako složku buněčnou lze použít buňky již diferencované nebo buňky progenitorové a kmenové, jejichž diferenciace v žádoucí fenotyp je pak navozena vhodnými vlastnostmi nosiče. Tkáňová náhrada, která byla konstruována z buněčné složky a jejího vhodného nosiče, se nazývá bioarteficiální tkáňová náhrada.
Pondělí
9.00-10.15: Přednáška mentora: MUDr. L. Bačáková, CSc, FgU AVČR: Úvod do problematiky tkáňového inženýrství obecně a se zaměřením na specifika cévních náhrad. Následují dotazy studentů a diskuse.
10.45-12.00: Metodická přednáška + ukázky (Mgr. Jana Lišková, PhD) Základní typy sterilizace vzorků materiálu pro kultivaci Základy izolace a kultivace buněk, jejich nasazení na materiál pro kultivaci v klasickém statickém systému. Princip sledování růstu buněk v přístroji xCeLLigence Real Time Cell Analyser
12.00 - 13.00: Oběd
13.00 – 14.30: Praktická cvičení (vede Mgr. Jana Lišková, PhD, s asistenty): manipulace se vzorky materiálů (pokud možno jednoduché malé planární vzorky, např. ve tvaru koleček či čtverečků) - jejich sterilizace, vložení do kultivačních nádob a jejich osazení buňkami, počítání buněk v Bürkerově hematologické komůrce i v automatickém přístroji ViCell Analyser, který zároveň hodnotí i viabilitu buněk.
15.00-17.00: Nasazení různých typů a koncentrací buněk (různé linie endotelových a hladkých svalových buněk, fibroblasty) do senzorických destiček přístroje xCeLLigence Real Time Cell Analyser a uvedení přístroje do chodu.
Úterý
9.00-10.15: Přednáška zvaného lektora (MUDr. Jaroslav Chlupáč, IKEM, Praha): Experimentální endotelizace pletených cévních protéz z polyetyléntereftalátu v dynamickém průtokovém bioreraktoru a jejich následná implantace laboratornímu praseti. Přednáška bude doplněna ukázkami vzorků současně klinicky využívaných cévních protéz i experimentálních umělých materiálů (dodají spolupracující instituce: VŠCHT, ÚMCH AVČR, VÚP a.s., Elmarco s.r.o., IKEM apod.). Následují dotazy studentů a diskuse.
10.45-12.00: Metodická přednáška + ukázky (Mgr. Jana Lišková, PhD): Vizualizace buněk na materiálech (fixace, typy barvení, základy imunoflurescence I).
12.00.- 13.00: Oběd
13.00 - 14.30: Praktická cvičení (vede Mgr. Jana Lišková + asistenti): Fixace buněk na materiálech, fluorescenční barvení buněk na materiálech (Texas Red, Hoechst), fotografování několika zorných polí, počítání buněk na digitálních fotografiích a měření jejich adhesní plochy počítači obrazovou analýzou (např. Atlas, Tescan);
15.00 – 17.00: Začátek imunofluorescenčního barvení buněk, a to vybranými primárními protilátkami proti specifickým adhesním či cytoskeletárním proteinům. Buňky v protilátkách zůstanou do dalšího dne. Průběžné sledování růstu buněk v přístroji CeLLigence na monitoru počítače (automatické snímání populační hustoty buněk na základě změn elektrického odporu).
Středa
9.00 - 10.15: Přednáška zvaného lektora: RNDr. Eduard Brynda, CSc., ÚMCH AV ČR: Modifikace materiálů pro tkáňové inženýrství cév molekulami extracelulární matrix (ECM), fibrinu a oligopeptidickými ligandy specifickými pro adhesní receptory endotelových a hladkých svalových buněk.
10.45 - 12.00: Metodická přednáška (Mgr. Jana Lišková, PhD): Základy imunofluorescence II (primární a sekundární protilátky, excitace/emise sond, atd.), základy průtokové cytometrie
12.00 - 13.00: Oběd
13.00-14.30: Praktická cvičení (vede Mgr. Jana Lišková, PhD + asistenti): Stanovování celkového proteinu - výchozí bod metody ELISA.
15:00 - 17.00: Barvení fixovaných a nefixovaných buněk propidium iodidem, stanovení obsahu DNA a podílu živých a mrtvých buněk průtokovou cytometrií
Čtvrtek
9.00-10.15: Přednáška odborníka: Mgr. Elena Filová PhD, Fyziologický ústav AV ČR, Praha: Úvod do tkáňového inženýrství srdečních chlopní, ukázky současně užívaných i modely experimentálně vyvíjených chlopní
10.45-12.00: Metodická přednáška (Mgr. Jana Lišková, PhD): Kvantitativní hodnocení specifických proteinů metodou enzymatické imunosorbentní eseje (ELISA), semikvantitativní hodnocení průtokovou cytometrií
12.00- 13.00: Oběd
13.00-14.30: Praktická cvičení (vede Mgr. Jana Lišková, PhD + asistenti): Stanovování celkového proteinu - výchozí bod metody ELISA.
15:00 - 17.00:Demonstrace dynamických kultivačních systémů pro cévní, chlopenní či kostní tkáň.
Pátek
9.00-10.15: Přednáška zvaného lektora: Prof. Ing. Václav Švorčík, DrSc., VŠCHT Praha: Modifikace syntetických polymerů iontovou implantací, UV zářením v reaktivních atmosférách a plasmatickým výbojem, a jejich následné roubování biomolekulami a nanočásticemi pro tkáňové inženýrství
10.45-12.00: Výklad principu real-time PCR a demonstrace přístroje (vede Mgr. Jana Lišková, PhD).
12.00.- 13.00: Oběd
13.00 - 14.30: Praktická cvičení (vede Mgr. Jana Lišková, PhD + asistenti): Hodnocení kvantitativních výsledků (počet a plocha buněk, obsah proteinu) jejich statistické porovnání na různých materiálech (software Excel), konečné vyhodnocení výsledků průtokové cytometrie, výsledků sledování růstu buněk v přístroji xCeLLigence).
15.00 - 17.00: Test znalostí získaných během kursu, diskuse a závěr
(vede mentor: MUDr. L. Bačáková, CSc.)
Případná změna zvaného lektora vyhrazena!
Obrázková Příloha
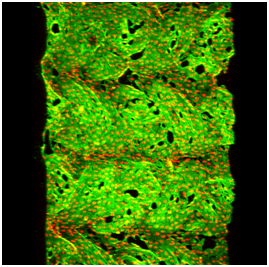
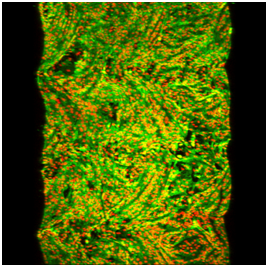
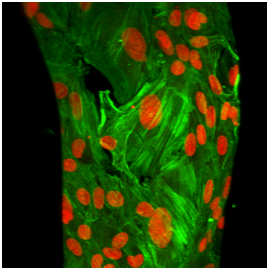
A: Drsný a vysoce hydrofobní vnitřní povrch protézy, nevhodný pro adhesi buněk; B: Pokrytí tohoto povrchu definovanými molekulárními vrstvami fibrinu, kolagenu I a fibronektinu (konjugovány s fluorescenčními markery); C, D: souvislá vrstva endotelových (C) a hladkých svalových buněk (D) na vnitřním povrchu vrapované protézy; E, F: detail endotelových (E) a hladkosvalových buněk (F). Imunofluorescence beta-aktinu (C, E) či alfa aktinu (D, F). Microscop Olympus IX 51 (A, B) nebo konfokální mikroskop Leica TCS SP2 AOBS, 60x1µm, obj. 10x (C, D) či 60x (E, F).



A: Nová budova, oddělení je v přízemí; B: Místnost pro buněčné kultury, nasazování buněk na umělé materiály vyvíjené pro tkáňové inženýrství v boxu s laminárním prouděním vzduchu; C: Kultivace buněk na umělých materiálech v dynamickém bioreaktoru; D: Vizualizace buněk na materiálech pomocí fluorescenčního barvení; E: Fotografování buněk v invertovaném mikroskopu vybaveném fluorescencí a digitální kamerou; F: Práce v imumocytochemické laboratoři; G: Počítačové vyhodnocení získaných výsledků; H: Seminář v zasedací místnosti.









